
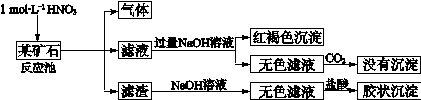
 Si + 2CO↑ (2分) (2)ac(2分)
Si + 2CO↑ (2分) (2)ac(2分) Si + 2CO↑。
Si + 2CO↑。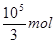 ,所以理论上至少需要1 mol L-1 HNO3的体积为L3.33×104。
,所以理论上至少需要1 mol L-1 HNO3的体积为L3.33×104。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源:不详 题型:单选题
| A.钠在空气中燃烧生成淡黄色的Na2O2 |
| B.将SO2通入过量BaCl2溶液可生成BaSO3沉淀 |
| C.新制氯水显酸性,向其中滴加少量紫色石蕊试液,振荡后溶液最终呈红色 |
| D.点燃的镁条插入盛有CO2的集气瓶中,立即熄灭 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钠露置在空气中表面生成淡黄色的Na2O |
| B.将SO2通入BaCl2溶液可生成BaSO3沉淀 |
| C.将CO2通入次氯酸钙溶液可生成次氯酸 |
| D.将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 |
| C.浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 |
| D.将SO2通入品红溶液,溶液退色后加热恢复原色;将SO2通入溴水,溴水退色后加热也能恢复原色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性; 2 Na + 2 H2O  2 NaOH+ H2↑ 2 NaOH+ H2↑ |
| B.氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2 + Cl2 2HCl |
C.FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色; 2Fe(OH)2 + O2 + H2O  2 Fe(OH)3 2 Fe(OH)3 |
| D.向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,有透明的硅酸凝胶产生; |
 H2SiO3(胶体) + 2NaCl
H2SiO3(胶体) + 2NaCl查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.漂白粉长期暴露在空气中变质:漂白粉的主要成份被空气中的氧气氧化 |
| B.浓硫酸敞口露置于空气中质量分数减小:浓硫酸吸收空气中的水分 |
| C.常温时将铜片放入稀硫酸中无明显现象:产生了“钝化”现象 |
| D.亚硫酸钠溶液能使溴水褪色:亚硫酸钠具有强氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com