
������һЩ���ʵ��۷е����ݣ���ѹ����
|
|
�� |
�� |
Na2CO3 |
���ʯ |
ʯī |
|
�۵㣨�棩 |
63��65 |
97��8 |
851 |
3550 |
3850 |
|
�е㣨�棩 |
774 |
882��9 |
1850���ֽ����CO2�� |
---- |
4250 |
�����ƺ�CO2�ڳ�ѹ��890�淢�����·�Ӧ��4 Na��g��+ 3CO2��g�� 2 Na2CO3��l�� + C(s,���ʯ) ��H=��1080��9kJ/mol
2 Na2CO3��l�� + C(s,���ʯ) ��H=��1080��9kJ/mol
��1������Ӧ��10L�ܱ���������ѹ�½��У��¶���890�����ߵ�1860�棬����Ӧʱ��Ϊ10min, �����Ƶ����ʵ���������0��2mol����10min��CO2��ƽ����Ӧ����Ϊ ��
��2����ѹ�������ڽ��ʯ���Ʊ��������� ��
��3����CO2��g��+ 4Na��g��=2Na2O��s��+ C��s�����ʯ�� ��H=��357��5kJ/mol����Na2O������C�����ʯ����Ӧ�õ�Na��g����Һ̬Na2CO3��l�����Ȼ�ѧ����ʽ ��
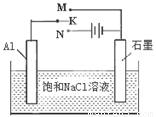
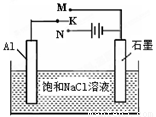
��4����ͼ����K��Mʱ��ʯī�缫��ӦʽΪ ��
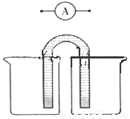
��5��������ԭ���ԭ�����ʵ�飬��֤Cu2����Ag+�����Ե�ǿ����
�ڷ����ڻ���ʵ��װ��ͼ��Ҫ�����ձ�������(��ͬһ�ձ��У�
�缫����Һ����ͬ�Ľ���Ԫ��)����������·��������
��1��0��0015 mol/��L ��min����2�֣�
��2������ѹǿ�ӿ췴Ӧ���ʣ���Ӧ������Ӧ�����ƶ���2�֣���
��3��3Na2O��s��+C��s,���ʯ) = 4Na��g��+Na2CO3��l����H= ��4��2kJ/mol��2�֣���
��4��O2+2H2O+4e�� =4OH����2�֣���
��5��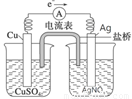 ��2�֣�
��2�֣�
��������
�����������1���ȸ��ݶ���ʽ��v(Na)���ٸ�������֮�ȵ��ڻ�ѧ����ʽ�е�ϵ��֮����v(CO2)����v(Na) =0��0020mol/(L•min)�� v(CO2)=3 v(Na)/4=0��0015mol/(L•min)����2������ѹǿ�ӿ췴Ӧ���ʣ���Ӧ������Ӧ�����ƶ�����3������֪�����Ȼ�ѧ����ʽ���Ϊ�٢ڣ��١��ڡ�3����Լȥ3 CO2(g)�����ݸ�˹���ɣ���6Na2O(s)+2C(s�����ʯ)=8Na(g)+2Na2CO3(l) ��H=��8��4kJ/mol����ϵ�����룬���ʱ�Ҳ���룬��3Na2O(s)+ C(s�����ʯ)=4Na(g)+Na2CO3(l) ��H=��4��2kJ/mol����4����K��M�����װ��Ϊԭ��أ�ģ������������ʴ����������ʯī���ã������Ǹ�����ʯī��������������ӦʽΪAl��3e��=Al3+��������ӦʽΪO2+4e��+2H2O=4OH������5����֤Cu2����Ag+�����Ե�ǿ�����ɸ����û���Ӧ��
Cu+2Ag+=Cu2��+2Ag�����ԭ��أ�ͭ����������Ӧ�������ӷ�����ԭ��Ӧ������ͭ����������������������ͭ�����������������Һ��
���㣺���黯ѧ��Ӧ���ʡ���ѧƽ�⡢�绯ѧ�����֪ʶ��


 һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�









�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| Ԫ��A | Ԫ��B | Ԫ��C | Ԫ��X | Ԫ��Y | Ԫ��Z |
| ������һ�ֳ�����������Ԫ��X�γɺ�ɫ��ש��ɫ���ֻ����� | ������һ�ֻ���ɫ���� | �������н�������ǿ����X��Ӧ���������ֻ����� | �������������ڲ��������3�������γ�˫ԭ�������� | ����Ϊ˫ԭ�ӷ��ӣ��ṹ�ЦҼ���м���Ŀ��Ϊ1��2 | �����Ӿ���һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ������ | ȼ���� | ������ | ȼ���� |
| ���� | 891.0 | ������ | 2 878.0 |
| ���� | 1 560.8 | �춡�� | 2 869.6 |
| ���� | 2 221.5 | 2-������ | 3 531.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��㶫ʡ��ɽ�и�����ѧ������⣨�������ۻ�ѧ�Ծ��������棩 ���ͣ�������
������һЩ���ʵ��۷е����ݣ���ѹ����
|
|
�� |
�� |
Na2CO3 |
���ʯ |
ʯī |
|
�۵㣨�棩 |
63.65 |
97.8 |
851 |
3550 |
3850 |
|
�е㣨�棩 |
774 |
882.9 |
1850���ֽ����CO2�� |
---- |
4250 |
�����ƺ�CO2�ڳ�ѹ��890�淢�����·�Ӧ��
4 Na��g��+ 3CO2��g�� 2
Na2CO3��l��+ C(s�����ʯ) ��H=��1080.9kJ/mol
2
Na2CO3��l��+ C(s�����ʯ) ��H=��1080.9kJ/mol
��1��������Ӧ��ƽ�ⳣ������ʽΪ ����4v��(Na)=3v��(CO2)����Ӧ�Ƿ�ﵽƽ�� ��ѡ��ǡ�����
��2������Ӧ��10L�ܱ���������ѹ�½��У��¶���890�����ߵ�1680�棬����Ӧʱ��Ϊ10min, �����Ƶ����ʵ���������0.20mol����10min��CO2��ƽ����Ӧ����Ϊ ��
��3����ѹ�������ڽ��ʯ���Ʊ��������� ��
��4����CO2��g��+4Na��g��=2Na2O��s��+C��s�����ʯ�� ��H=��357.5kJ/mol����Na2O������C�����ʯ����Ӧ�õ�Na��g����Һ̬Na2CO3��l�����Ȼ�ѧ����ʽ ��
��5����ͼ����K��Mʱ��ʯī�� �����缫��ӦʽΪ ��K��Nһ��ʱ�������0.3mol����ת�ƣ�����y��x�仯��ͼ��x������n(H2O)������y������n��Al(OH)3�ݣ���Ӧ�������������й����ݡ�

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com