
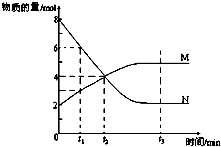
 一定温度下,某容积为2L的密闭容器内,某一反应中M(g)、N(g)的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M(g)、N(g)的物质的量随反应时间变化的曲线如图,依图所示:分析 (1)M物质的量增大、N的物质的量减小,故N为反应物、M为生成物,最终N的物质的量不变且不为0,则该反应属于可逆反应,根据物质的量之比等于化学计量数之比确定化学计量数,进而书写反应方程式;
(2)0-t2 时间段内△n(N)=8mol-4mol=4mol,再根据v=$\frac{△c}{△t}$计算v(N);
(3)利用化学平衡状态的特征“等”、“定”来判断反应达到平衡状态;
(4)升高温度、增大压强、增大物质的浓度、使用催化剂等可以加快反应速率.
解答 解:(1)M物质的量增大、N的物质的量减小,故N为反应物、M为生成物,最终N的物质的量不变且不为0,则该反应属于可逆反应,△n(N)=8mol-2mol=6mol,△n(M)=5mol-2mol=3mol,则N、M的化学计量数之比为2:1,故反应方程式为:2N?M,
故答案为:2N?M;
(2)0-t2 时间段内△n(N)=8mol-4mol=4mol,则v(N)=$\frac{\frac{4mol}{2L}}{{t}_{2}min}$=$\frac{2}{{t}_{2}}$mol/(L.min),故答案为:$\frac{2}{{t}_{2}}$mol/(L.min);
(3)A.反应方程式为:2N?M,反应前后气体物质的量不相等,恒温恒容下,随反应想容器内压强发生变化,压强不变说明反应到达平衡,故A正确;
B.混合气体的质量、体积一直不变,则密度始终不变,不能作为判断平衡的依据,故B错误;
C.因混合气体的质量一直不变,该反应是物质的量在减少的化学反应,则混合气体的摩尔质量随时间的变化而变化,相对分子质量与摩尔质量数值上相等,故混合气体的相对分子质量不再变化说明达到平衡状态,故C正确;
D.反应方程式为:2N?M,化学反应速率之比始终等于化学计量数之比,故v(N)=2v(M)不能作为判断平衡的依据,故D错误;
故选AC;
(4)A.升高温度,反应速率加快,故A正确;
B.降低压强,反应速率减慢,故B错误;
C.减小M的浓度,反应速率减慢,故C错误;
D.将反应容器体积缩小,压强增大,浓度增大,反应速率加快,故D正确;
故选AD.
点评 本题考查化学平衡计算、平衡状态特征、反应速率计算及影响因素,比较基础,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 根据上表,向足量NaClO溶液中通入CO2:CO2+H2O+2ClOˉ═2HClO+CO32- | |
| B. | 向上述 NaClO溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>c(HClO) | |
| C. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| D. | 若将CO2通入0.1mol•L-1Na2CO3溶液中至溶液中性,则溶液中2c(CO32-)+c (HCO3-)=0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯为纯净物;聚乙烯为混合物 | |
| B. | 等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 | |
| C. | 乙烯的化学性质比聚乙烯活泼 | |
| D. | 乙烯和聚乙烯都能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.
硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com