
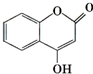
 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成: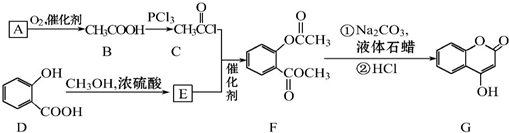
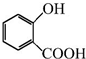 +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$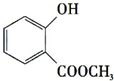 +H2O.
+H2O. +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O.分析 A与银氨溶液反应有银镜生成,则A中存在醛基,由流程可知A与氧气反应可以生成乙酸,则A为CH3CHO,由B和C的结构简式可以看出,乙酸分子中的羟基被氯原子取代,发生了取代反应,D与甲醇在浓硫酸条件下发生酯化反应生成E,则E的结构简式为 ,由F的结构简式可知,C和E 在催化剂条件下脱去一个HCl分子得到F,据此解答.
,由F的结构简式可知,C和E 在催化剂条件下脱去一个HCl分子得到F,据此解答.
解答 解:A与银氨溶液反应有银镜生成,则A中存在醛基,由流程可知A与氧气反应可以生成乙酸,则A为CH3CHO,由B和C的结构简式可以看出,乙酸分子中的羟基被氯原子取代,发生了取代反应,D与甲醇在浓硫酸条件下发生酯化反应生成E,则E的结构简式为 ,由F的结构简式可知,C和E 在催化剂条件下脱去一个HCl分子得到F,
,由F的结构简式可知,C和E 在催化剂条件下脱去一个HCl分子得到F,
(1)由以上分析可知,A为CH3CHO,与银氨溶液反应的离子方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH3COONH4+2Ag↓+3NH3+H2O,
故答案为:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$CH3COONH4+2Ag↓+3NH3+H2O;
(2)D→E的化学方程式为: +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为: +CH3OH$?_{△}^{浓硫酸}$
+CH3OH$?_{△}^{浓硫酸}$ +H2O;
+H2O;
(3)F和过量NaOH溶液共热时反应的化学方程式为: +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O,
+CH3COONa+CH3OH+H2O,
故答案为: +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O;
+CH3COONa+CH3OH+H2O;
(4)G分子的结构中存在苯环、酯基、羟基、碳碳双键,所以能够与溴单质发生加成反应或者取代反应,能够与金属钠反应产生氢气,a和b正确;1molG含有1mol碳碳双键和1mol苯环,所以需要4mol氢气,c错误,
故答案为:ab;
(5)E( )的同分异构体很多,除E外符合下列条件:①含苯环且能与氯化铁溶液显色,含有酚羟基,②苯环上有两个取代基,③含酯基,酯基为-CH2OOCH或-OOCCH3或-COOCH3,与酚羟基均有邻、间、对三种位置,故除E外同分异构体有3×3-1=8种,
)的同分异构体很多,除E外符合下列条件:①含苯环且能与氯化铁溶液显色,含有酚羟基,②苯环上有两个取代基,③含酯基,酯基为-CH2OOCH或-OOCCH3或-COOCH3,与酚羟基均有邻、间、对三种位置,故除E外同分异构体有3×3-1=8种,
故答案为:8.
点评 本题考查有机物的推断、有机物结构与性质、有机反应类型、同分异构体等,难度不大,注意掌握有机物官能团的性质和转化,结合反应条件及有机物结构简式进行解答.


科目:高中化学 来源: 题型:选择题
| A. | 铜片与稀硝酸共热 | B. | 二氧化锰与盐酸共热 | ||
| C. | 锌与稀硫酸共热 | D. | 稀盐酸与碳酸钙的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、
、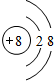 、
、 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含共价键 | B. | 碱和铵盐都是离子化合物 | ||
| C. | 离子化合物中不一定含金属元素 | D. | 离子化合物中一定含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂、乙酸乙酯都属于酯类,水解后都会生成乙醇 | |
| B. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
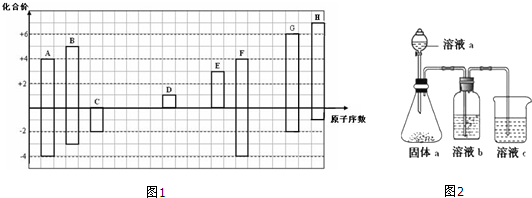
 ,其所含化学键类型为离子键.
,其所含化学键类型为离子键.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

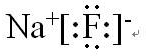
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com