
分析 (1)根据n=$\frac{m}{M}$进行计算求解;
(2)标准状况下,两者的体积之比等于物质的量之比,CO与CO2含有相同氧原子数两者的物质的量之比为2:1;
(3)在硫酸钠溶液中,n(Na+)=2n(SO42-),所以n(SO42-)=0.1mol,根据c=$\frac{n}{V}$进行计算;
(4)先根据二价金属A的氯化物的分子式,由Cl-的物质的量求出氯化物的物质的量,再根据公式M=$\frac{m}{n}$来确定分子的摩尔质量,摩尔质量在数值上和相对分子质量的大小相等,最后根据相对分子质量的大小确定金属元素的相对原子质量;
(5)n(CO)=$\frac{6.72L}{22.4L/mol}$=0.3mol,发生3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,结合m=nM计算.
解答 解:(1)n=$\frac{m}{M}$=$\frac{0.6g}{2g/mol}$=0.3mol,故答案为:0.3;
(2)标准状况下,两者的体积之比等于物质的量之比,CO与CO2含有相同氧原子数两者的物质的量之比为2:1,所以体积之比为2:1,故答案为:2:1;
(3)在硫酸钠溶液中,n(Na+)=2n(SO42-),所以n(SO42-)=0.1mol,根据c=$\frac{n}{V}$=$\frac{0.1mol}{0.1L}$=1mol/L,故答案为:1mol/L;
(4)因某二价金属的氯化物ACl2中含有0.2molCl-可知,氯化物ACl2的物质的量为$\frac{0.2mol}{2}$=0.1mol,则M(ACl2)=$\frac{m}{n}$=$\frac{9.5g}{0.1mol}$=95g/mol,所以ACl2相对分子质量为95,则A的相对原子质量为95-35.5×2=24,
故答案为:95g/mol;24;
(5)n(CO)=$\frac{6.72L}{22.4L/mol}$=0.3mol,发生3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,可知恰好完全反应后,剩余固体的质量为0.2mol×56g/mol=11.2g,故答案为:11.2g.
点评 本题考查了物质的量的有关计算,利用质量、摩尔质量、物质的量之间的关系公式来解答,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解NaH2PO2溶液,其阳极反应式为2H2O-4e-=O2↑+4H+ | |
| B. | 将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4 | |
| C. | H3PO2溶于水的电离方程式为H3PO2?H++H3PO2- | |
| D. | H3PO2与过量NaOH溶液反应的离子方程式为H3PO2+3OH-=PO23-+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH2OH和H2 | B. | CH4和CH3CH2CH3 | ||
| C. | CH2═CH2和CH2═CH-CH3 | D. |  和H-C≡C-H 和H-C≡C-H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
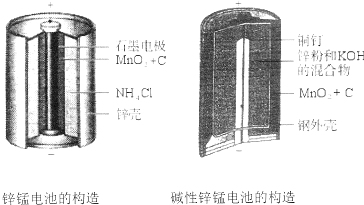
| A. | 该电池反应中二氧化锰起催化作用 | |
| B. | 电池负极反应式为:2MnO2+2e-+2H2O═2MnOOH+2OH- | |
| C. | 当0.1molZn完全反应时,流经电池内部的电子个数为1.204×1023 | |
| D. | 碱性锌锰电池用锌粉替代了原锌锰电池的锌壳,增大了反应物的接触面积,加快了反应速率,故放电电流大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
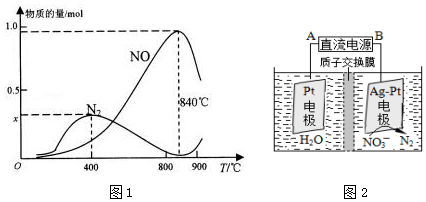
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该过程是将太阳能转化为化学能的过程 | |
| B. | 电极a表面发生还原反应 | |
| C. | 该装置工作时,H+从b极区向a极区移动 | |
| D. | 该装置中每生成1 mol CO,同时生成1 mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铬元素在周期表中处于第四周期V IB族 | |
| B. | 铬原子的外围电子层排布为3d44s2 | |
| C. | 铬原子中,质子数为24 | |
| D. | 铬元素位于元素周期表的d区,是过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 次氯酸的电离方程式:HClO=H++ClO- | |
| C. | Na+的结构示意图: | |
| D. | 赤铁矿的主要成分:Fe3O4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com