
【题目】根据所学知识完成题目:
(1)有以下10种物质:①铁 ②稀硫酸 ③氯化氢 ④氨气 ⑤空气 ⑥二氧化碳 ⑦水银 ⑧氯化镁 ⑨硫酸钡=10 ⑩蔗糖.其中属于电解质的是 .
(2)写出⑧在水溶液中的电离方程式 .
(3)写出①与水蒸气反应的化学方程式 .
【答案】
(1)③⑧⑨
(2)MgCl2=Mg2++2Cl﹣
(3)3Fe+4H2O(g) ![]() Fe3O4+4H2
Fe3O4+4H2
【解析】解:(1)①铁是单质,不是电解质; ②稀硫酸是混合物不是电解质; ③氯化氢水溶液能够导电,是化合物,属于电解质; ④氨气本身不能电离,属于非电解质; ⑤空气是混合物,不是电解质; ⑥二氧化碳本身不能电离,属于非电解质;⑦水银是单质,不是电解质; ⑧氯化镁在水溶液或者熔融状态下能够导电的化合物是电解质; ⑨硫酸钡熔融状态下能够导电的化合物,属于电解质; ⑩蔗糖在水溶液和熔融状态下都不导电的化合物是非电解质;所以属于电解质的是③⑧⑨;所以答案是:③⑧⑨;(2)氯化镁为强电解质,完全电离,电离方程式:MgCl2=Mg2++2Cl﹣;所以答案是:MgCl2=Mg2++2Cl﹣;(3)铁与水蒸气在高温条件下反应生成四氧化三铁和氢气,离子方程式:3Fe+4H2O(g) ![]() Fe3O4+4H2;所以答案是:3Fe+4H2O(g)
Fe3O4+4H2;所以答案是:3Fe+4H2O(g) ![]() Fe3O4+4H2 .
Fe3O4+4H2 .


科目:高中化学 来源: 题型:
【题目】Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)N位于周期表中第 周期 族,与N3-含有相同电子数的三原子分子的空间构型是 。
(2)C、N、O三种元素的第一电离能由大到小的顺序为
(3)Cu+电子排布式为 ,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu20,试从结构角度解释高温下CuO何会生成Cu2O: 。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是 ,乙醛分子中H—C—O的键角 (填“大于”“等于”或“小于”)乙醇分子中的H—C一0的键角。
(5)[Cu(H20)4]2+为平面正方形结构,其中的两个H20被Cl-取代有两种不同的结构,试画出[Cu(H20)2(C1)2]具有极性的分子的结构式: 。
(6)Cu3N的晶胞结构如图,N3-的配位数为 ,Cu+半径为a pm,N3- 半径为b pm,Cu3N的密度为 g·cm-3。(阿伏加德罗常数用NA表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。
某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:


请回答下列问题:
(1)三颈烧瓶中发生的主要反应的化学方程式为___________________________________;
(2)支管B的作用是_________________________;
(3)步骤③中洗涤CaO2·8H2O的液体X的最佳选择是____________;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
(4)过氧化钙可用于长途运输鱼苗,这体现了过氧化钙___________的性质;
A.可缓慢供氧 B.能吸收鱼苗呼出的CO2气体 C.能潮解 D.可抑菌
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①检查该装置气密性的方法是:_________________________________;
②使用________(填仪器名称)准确称取0.5000g样品,置于试管中加热使其完全分解,收集到33.60mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为________(保留4位有效数字);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
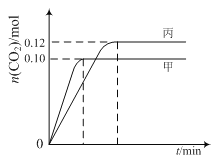
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)>v(逆)
D. T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石(主要成分为 CuCO3·Cu(OH)2、CuSiO3·2H2O,含 SiO2、FeCO3、 Fe2O3等杂质)为原料制备CuCl2的工艺流程如下:
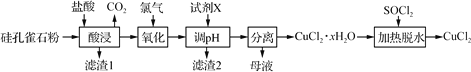
已知:SOCl2+H2O![]() SO2↑+2HCl↑
SO2↑+2HCl↑
(1)“酸浸”时盐酸与CuCO3Cu(OH)2反应的化学方程式为____。为提高“酸浸”时铜元素的浸出率,可以采取的措施有:①适当加快搅拌速率;②______________。(任答一点即可)
(2)“氧化”时发生反应的离子方程式为__________。
(3)“滤渣1”的主要成分为SiO2和H2SiO3等,“滤渣2”的主要成分为______________(填化学式);试剂X可选择_____(填字母)。
a. Cu b. NaOH c. Cu(OH)2 d.氨水
(4)“调pH”时,pH不能过高,其原因是_________________________。
(5)“加热脱水”时,加入SOCl2的目的是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl 和BaCl2 两种固体混合物,试回答下列问题: 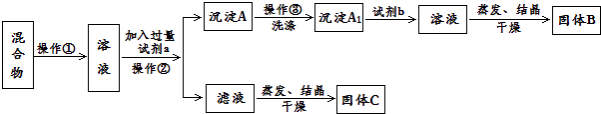
(1)操作①的名称是 , 操作②的名称是 .
(2)试剂a是 , 试剂b是 , 固体B是 . (填化学式)
(3)加入试剂a所发生反应的化学方程式为: . 加入试剂b所发生反应的化学方程式为: .
(4)该方案能否达到实验目的: . 若不能,应如何改进(若能,此问不用回答) .
(5)若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是的质量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Al2O3为原料制取氢氧化铝,最好的方法是( )
A.将Al2O3溶于水
B.将Al2O3先溶于盐酸中,之后滴加氢氧化钠溶液
C.将Al2O3先溶于盐酸中,之后滴加氨水
D.将Al2O3先溶于NaOH溶液中,之后滴加盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com