
下列贮存化学试剂的方法正确的是
A.在盛液溴的试剂瓶中加水,形成“水封”,以减少溴挥发
B.用做感光片的溴化银贮存在无色试剂瓶中
C.烧碱溶液放在带磨口玻璃塞的试剂瓶中
D.新制的氯水保存在棕色广口瓶中,并放在阴凉处
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:填空题
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:
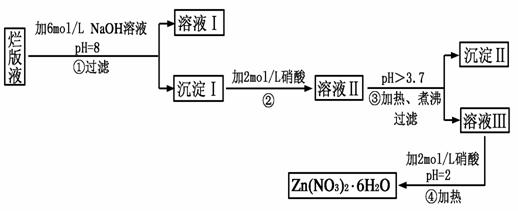
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
生成氢氧化物沉淀的pH
Fe(OH)3 | Zn(OH)2 | |
开始沉淀时 | 1.5 | 8.0 |
完全沉淀时 | 2.8 | 11.1 |
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)“烂版液”中溶质的主要成分是Zn(NO3)2,若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式_____________________________。
(2)在操作①中保持pH=8的目的是____________________________。
(3)沉淀Ⅰ的主要成分是_______________________________________。
(4)操作③中调节pH的范围是___________________;目的是________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上期中测试化学试卷(解析版) 题型:选择题
下列热化学方程式中△H代表燃烧热的是( )
A.CH4 ( g ) + 3/2O2 ( g ) = 2H2O ( l ) + CO ( g ) △H1
B.S ( s ) + 3/2O2 ( g ) = SO3 ( s ) △H2
C.C6H12O6 ( s ) + 6O2 ( g ) = 6CO2 (g) + 6H2O ( l ) △H3
D.2CO ( g ) + O2 ( g ) = 2CO2 ( g ) △H4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上11月月考化学试卷(解析版) 题型:选择题
常温下,下列溶液的pH或微粒的物质的量浓度关系不正确的是 ( )
A.pH=5.2的CH3COOH与CH3COONa混合溶液中,c(Na+)<c(CH3COO-)
B.在滴加酚酞溶液的氨水中,加入NH4Cl溶液恰好无色,则此时溶液的pH﹤7
C.Na2CO3溶液中,c(OH-)-c(H+)= c(HCO3-)+2 c(H2CO3)
D.pH=2的一元酸溶液与pH=12的NaOH溶液等体积混合,则溶液的pH一定不大于7
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上期中测试化学试卷(解析版) 题型:选择题
一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如右图所示,则下列说法正确的是
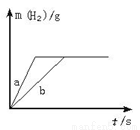
A.投入的Na、K一定等质量 B.投入的Na的质量小于K的质量
C.曲线a为Na,b为K D.稀盐酸的量一定是不足量的
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列各表述与示意图一致的是( )
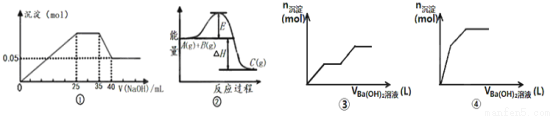
A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图。则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:1:2,其中使用的NaOH的浓度为2 mol·L-1。
B.图②中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)时,
△H>0,若使用正催化剂,E值会减小。
C.图③可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图
D.图④表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的物质的量(n)
与加入Ba(OH)2溶液体积(V)之间的关系图
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上期中(理)化学试卷(解析版) 题型:填空题
在一定温度下,10L恒容密闭容器中加入0.05molSO2、0.03molO2,反应为:
2SO2(g)+O2(g)=2SO3(g) ΔH<0,经10min后反应达到平衡,测得C(SO3)=0.004mol/L
(1) SO2的转化率为 ,若在原平衡的基础上再加入0.05molSO2、0.03molO2达到平衡时,SO2的转化率将 (填增大、减小或不变)
(2) 用SO2表示该反应的反应速率为
(3) 平衡时容器内气体压强与反应前的压强之比 (最简整数比)
(4) 平衡时体系中SO3的百分含量(体积分数)
(5) 平衡常数K= ;升高温度K将 (填增大、减小或不变);假如某时刻时SO2为0.02mol,该反应向 (填正向、逆向或不)移动。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南省高二上12月段考化学试卷(解析版) 题型:选择题
某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是
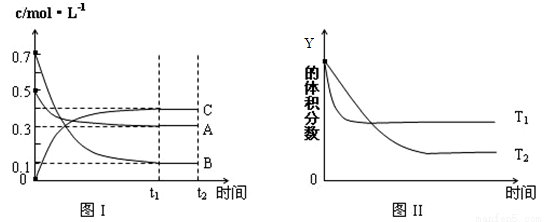
A.该反应的热化学方程式为:X(g)+3Y(g) 2Z(g);△H<0
2Z(g);△H<0
B.若其它条件不变,升高温度,正、逆反应速率均增大,X的转化率增大
C.达到平衡后,若其他条件不变,减小体积,平衡向逆反应方向移动
D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古赤峰二中高一上第二次月考化学试卷(解析版) 题型:选择题
在标准状况下,m g气体A与n g气体B的分子数相同,下列说法中不正确的是( )
A.两种气体A与B的相对分子质量之比为m∶n
B.同质量气体A与B的分子数之比为n∶m
C.同温同压下,A与B两气体的密度之比为n∶m
D.相同状况下,同体积A与B两气体的质量之比为m∶n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com