
【题目】LiOH是制取锂和锂的化合物的原料,用电解法制备LiOH的工作原理如下图所示:

下列叙述不正确的是
A. b极附近溶液的pH减小
B. a极发生的反应为2H2O-4e-===O2↑+4H+
C. 该法制备LiOH还可得到硫酸和氢气等产品
D. 当电路中通过1mol电子时,可得到1mol LiOH
科目:高中化学 来源: 题型:
【题目】关于化学科学的说法,正确的是:
A.化学是在质子变化的层次上研究物质的一门基础学科
B.化学学科的特征是从宏观和微观两个角度认识物质
C.化学学科研究物质性质但不能创造出新物质
D.化学学科表征物质的方法与物理学科完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.SO2的水溶液能导电,所以SO2是电解质
B.酸式盐的水溶液呈酸性
C.醋酸溶液中醋酸的电离程度随温度的升高而增大
D.FeCl3的溶液加热蒸干可得到FeCl3的晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g)+nB(g)cZ(g)△H的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( ) 
A.在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平衡时,Z的物质的量分数增大
B.升高温度,正、逆反应速率都增大,平衡常数增大
C.△H>0,m+n>c
D.温度不变,减小压强,平衡逆向移动,达新平衡时,A的浓度比原平衡减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分 | 含量/(mg·L-1) | 成分 | 含量/(mg·L-1) |
Cl- | 18980 | Ca2+ | 400 |
Na+ | 10560 | HCO3- | 142 |
SO42- | 2560 | Br- | 64 |
Mg2+ | 1272 |
(1)电渗析法淡化海水示意图如下图所示;其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
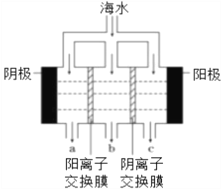
①阳极主要电极反应式是____________。
②在阴极附近产生少量白色沉淀,两种主要的成分为____________。
③淡水的出口为_______(填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:

①从MgCl2·6H2O晶体得到无水MgCl2的主要实验操作是_______________。
②依据上述流程,若将0.5m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为_________L(忽略Cl2溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备H2的一种重要方法是:CO(g)+H2O(g)CO2 (g)+H2(g)△H=QkJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定容积的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如表:已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c4 |
4 | c1 | c2 | c3 | c4 |

(1)Q0(填“>”、“=”或“<”).
(2)若在850℃时向反应容器中充人H2O(g),K值(填“增大”、“减小”或“不变”).
(3)上表中 c2为mol/L,CO(g)的转化率为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com