
分析 (1)已知1g液态肼完全反应生成气态水放出的热量为20kJ,求出1mol液态肼完全反应生成气态水放出的热量,结合盖斯定律计算液态肼与液态双氧水反应生成N2和液态水的反应热和热化学方程式;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,化学反应的焓变=旧键断裂吸收的能量-新键生成释放的能量;
(3)①H2(g)+O2(g)═H2O2(l)△H1=-134.3kJ•mol-1;
②H2O(l)═H2(g)+$\frac{1}{2}$O2(g)△H2=+286kJ•mol-1.
则反应③H2O2(l)═H2O(l)+$\frac{1}{2}$O2等于-(①+②)得到,根据盖斯定律计算焓变.
解答 解:(1)1g液态肼完全反应生成气态水放出的热量为20kJ,则32g即1mol肼燃烧放热640kJ,热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-640kJ/mol①;
H2O(l)═H2O(g)△H=+44kJ/mol②;
依据盖斯定律,①-②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-816kJ/mol;
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-816kJ/mol;
(2)由N2、H2合成气态肼(N2H4)的反应为:N2(g)+2H2(g)═N2H4(g)焓变=946kJ•mol-1+2(436kJ•mol-1)-[4(390.8kJ•mol-1)+193kJ•mol-1]=+61.8 kJ•mol-1;
故答案为:N2(g)+2H2(g)═N2H4(g)△H=+61.8 kJ•mol-1;
(3)①H2(g)+O2(g)═H2O2(l)△H1=-134.3kJ•mol-1;
②H2O(l)═H2(g)+$\frac{1}{2}$O2(g)△H2=+286kJ•mol-1.
则反应③H2O2(l)═H2O(l)+$\frac{1}{2}$O2等于-(①+②)得到,根据盖斯定律焓变=-(286kJ•mol-1-134.3kJ•mol-1)=-151.7 kJ•mol-1,
故答案为:-151.7 kJ•mol-1.
点评 本题考查了反应热计算、热化学方程式的书写,题目难度中等,注意掌握化学键断裂、形成中的能力变化与焓变之间的关系,试题培养了学生的分析能力及化学计算能力.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测氨水溶液的体积/mL | 0.10mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
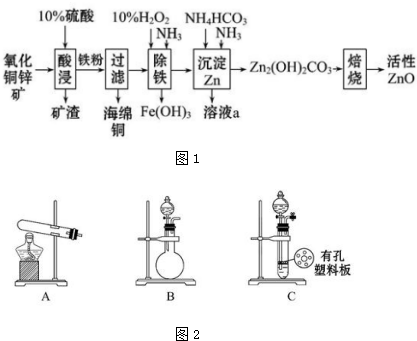
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 3.00mL | 21.10mL |
| 第三次 | 0.20mL | 20.40mL |
| 第四次 | 0.00mL | 18.20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 40% | C. | 50% | D. | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子电子层数增大 | |
| B. | 元素原子最外层电子数呈现周期性变化 | |
| C. | 元素的化合价呈现周期性变化 | |
| D. | 核电荷数依次增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com