
| A. | 蒸发、结晶与蒸发皿 | B. | 过滤与漏斗 | ||
| C. | 萃取、分液与分液漏斗 | D. | 蒸馏与蒸馏装置 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol/L NH4NO3溶液中含有铵根离子数目为0.1NA | |
| B. | 标准状况下,22.4 L SO3中含有的氧原子数为3NA | |
| C. | 标准状况下,22.4L氯气与含有1 mol FeI2的溶液反应时,转移的电子数为2NA | |
| D. | 常温常压下,16g O2作氧化剂时转移电子数一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| M | N | ||
| X | Y | Z |
| A. | 最简单氢化物的稳定性:M>N>Z | B. | 最高价含氧酸的酸性:Z>M>Y | ||
| C. | 单质的熔点:X>Z>N | D. | 简单离子的半径:Z>N>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了使豆腐白嫩和富有弹性,制作时可使用吊白块(具有漂白性)和烧碱 | |
| B. | 金属Mg失火时不能用泡沫灭火器扑灭 | |
| C. | 土壤胶粒带负电荷,有利于铵态氮肥的吸收 | |
| D. | 水玻璃可用于生产黏合剂和防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
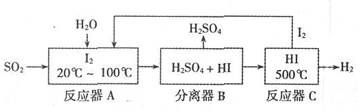
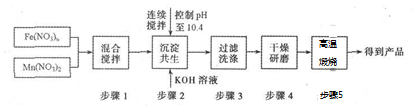
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中OH-向阴极迁移 | |
| B. | 阳极反应式为:4OH--4e-=O2↑+2H2O | |
| C. | 毎有l mol电子转移,生成标准状况下5.6L气体 | |
| D. | 电解过程中阴极区溶液的pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | H2CO3 | HClO |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2×10-12 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3×10-8 |
| A. | lmolCl2通入足量的水中充分反应,转移的电子数约为6.02×1023 | |
| B. | 将少量CO2气体通入NaClO溶液中的离子方程式:CO2+H2O+ClO-═HCO3-+HC1O | |
| C. | 常温下,用蒸馏水不断稀释醋酸,溶液中$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$的值不变 | |
| D. | 向浓度均为1×103 mol/L-1的KC1和K2CrO4混合溶液中滴加1×10-3 mol/L-1的AgNO3溶液Cl-先沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
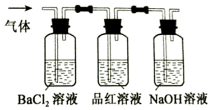 FeSO4受热分解的化学方程式为:2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO2↑+SO3↑
FeSO4受热分解的化学方程式为:2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO2↑+SO3↑查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 同主族元素性质的相似性 | 钠和氧反应可以形成Na2O2,也可以和硫形成Na2S2 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铁片分别加入足量的稀硫酸和浓硫酸中,浓硫酸中铁片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | H2O沸点低于H2S |
| D | 较强酸可以制取较弱酸 | 亚硫酸和次氯酸钙反应可以制取次氯酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com