
| A. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| B. | 0.1mol白磷(P4)所含的共价键数目为0.4 NA | |
| C. | 在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为7NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L |
分析 A.标准状况下水为液态;
B.白磷分子是P4,为正四面体结构,分子中为P原子处于正四面体的顶点,分子中含有6个P-P键;
C.依据方程式可知:生成4mol氯气转移7mol电子;
D.溶液的体积不等于水的体积.
解答 解:A.标准状况下水为液态,Vm≠22.4L/mol,无法计算水的物质的量,故A错误;
B.1个白磷分子含有6个P-P键,所以.1mol白磷(P4)所含的共价键数目为0.6NA,故B错误;
C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为7NA,故C正确;
D.溶液的体积不等于水的体积,所以含NA个Na+的Na2O溶解于1L水中形成溶液的体积不知道,无法计算其浓度,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的分析应用,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确气体摩尔体积的条件应用是解题关键,题目难度不大,注意白磷分子的空间结构.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
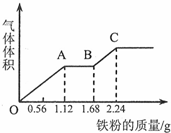 向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )
向100mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉,产生气体的体积(相同状况)随铁粉质量增加的变化如图所示.下列分析错误的是.( )| A. | 原混合酸溶液的pH=0,c(H2SO4)=0.1mol•L-1 | |
| B. | OA段的反应为:Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| C. | AB段的反应为:Fe+2Fe3+═3Fe2+ | |
| D. | BC段气体产物为氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 | |
| 乙醇 | 0.79 | -114 | 78 | 溶 |
| 乙酸 | 1.049 | 16.2 | 117 | 溶 |
| 乙酸乙酯 | 0.902 | -84 | 76.5 | 不溶 |
 OCH2CH3$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O
OCH2CH3$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O
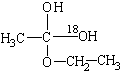 后消去失水,失水有两种可能分别生成
后消去失水,失水有两种可能分别生成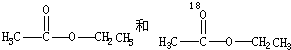 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 | 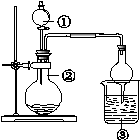 |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 生石灰 | AlCl3溶液 | Al(OH)3具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 醋酸 | Na2CO3 | Na2SiO3 | 非金属性:C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
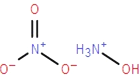 科学家研制的航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全、环保,预计最早将在今年进行卫星飞行试验.羟基硝酸铵的结构如图所示,下列说法不正确的是( )
科学家研制的航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高,更安全、环保,预计最早将在今年进行卫星飞行试验.羟基硝酸铵的结构如图所示,下列说法不正确的是( )| A. | 羟基硝酸铵中阳离子的各原子共平面 | |
| B. | 羟基硝酸铵是离子化合物 | |
| C. | 羟基硝酸铵中含有离子键和共价键 | |
| D. | 9.6g羟基硝酸铵中含有0.2mol离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L NO和O2混合气体的原子数为NA | |
| B. | 15g甲基所含有的电子数目为9NA | |
| C. | 1L0.1mol/L的氨水溶液中含有的N原子数大于0.1NA | |
| D. | 标准状况下,6.72L NO2与水反应转移电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
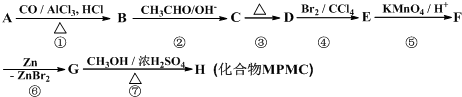
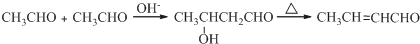
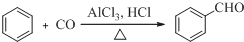
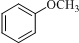 ;D
;D .
.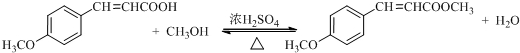 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com