
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.0.1mol乙烯和乙醇的混合物完全燃烧所消耗的O2一定为0.3 NA
B.常温常压下,46 g NO2与 N2O4的混合气体中含有的分子总数为NA
C.25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0 .1 NA
D.一定量的钠与8g氧气作用,若两者均无剩余,转移NA个电子
科目:高中化学 来源:2013-2014江苏省无锡市高一下学期期末考试化学试卷(解析版) 题型:选择题
巴豆酸是一种对胃肠道有强烈刺激性、对呼吸中枢和心脏有麻痹作用的有机酸,其结构简式为CH3—CH=CH—COOH,现有①氯化氢 ②溴水 ③纯碱溶液 ④乙醇 ⑤酸性高锰酸钾溶液
试根据其结构特点判断在一定条件下能与巴豆酸反应的物质是
A.只有②④⑤ B.只有①③④ C.只有①②③④ D.全部
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如下图,下列判断错误的是
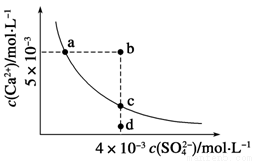
A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.a点对应的Ksp不等于c点对应的Ksp
C.b点将有沉淀生成,平衡后溶液中c(SO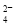 )一定等于3×10-3 mol·L-1
)一定等于3×10-3 mol·L-1
D.向d点溶液中加入适量CaCl2固体可以变到c点
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:实验题
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:
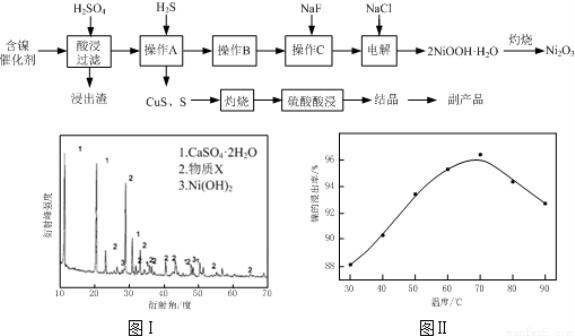
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含 量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价
(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则Ca2+的浓度为 mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下Cl-在阳极被氧化为ClO-;
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。
第②步反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:选择题
霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物,它在酸性溶液中能发生如下反应:

下列说法中正确的是
A.1molMMF与足量NaOH 溶液共热,最多可消耗3molNaOH
B.可以用NaHCO3溶液区别MMF与化合物Ⅰ
C.化合物R 的分子式为C6H12NO2
D.MMF分子中含有三种官能团
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:选择题
下列有关化学用语表述正确的是
A.羟甲基(-CH2OH)和甲氧基(CH3O-)电子数不相等
B.S2-的结构示意图: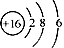
C.苯甲醛: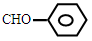
D.质子数为53,中子数为78的碘原子: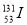
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:实验题
(12分)硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:

(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式: 。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是 。
(3)滤渣c是 。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为:
2NO+O2 =2NO2、 。
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,写出硫酸铜受热分解的化学方程式: 。
某同学设计了如下图所示的实验装置分别测定生成的SO2气体、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由: 。
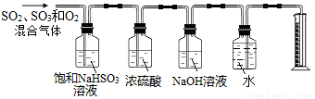
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:填空题
[物质结构与性质]
磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1) 基态Ni原子的价电子排布式是________。
(2) 丁二酮肟(结构简式如右图所示)中碳原子的杂化方式为________。
(3) NH3的沸点高于PH3,其主要原因是____。
(4) 与N3-离子具有相同电子数的三原子分子的空间构型是________。

(5) 向Ni(NO3)2溶液中滴加氨水,刚开始时生成绿色Ni(OH)2沉淀,当氨水过量时,沉淀会溶解,生成[Ni(NH3)6]2+的蓝色溶液,则1 mol[Ni(NH3)6]2+含有的σ键为________mol。
(6) 右图是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1 mol La的合金可吸附H2的数目为________。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:填空题
(12分)常温下,将某一元碱BOH和HCl溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HCl的物质的量浓度 (mol·L-1) | BOH的物质的量浓度 (mol·L-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=5 |
② | c | 0.2 | pH=7 |
③ | 0.1 | 0.2 | pH>7 |
请回答:
(1)从第①组情况分析,BOH是 (选填“强碱”或“弱碱”)。该组所得混合溶液中由水电离出的
c(OH—)= mol·L-1。
(2)第②组情况表明,c 0.2。该混合液中离子浓度c(B+) c(Cl—)(选填“<”、“>”或“=”)。
(3)从第③组实验结果分析,混合溶液中 (选填“<”、“>”或“=”)
甲:BOH的电离程度 BCl的水解程度
乙:c(B+)—2 c (OH—) c(BOH)—2 c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com