
【题目】在某密闭容器中,发生如下反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0 。下列研究目的和示意图相符的是( )
2NO2(g) △H<0 。下列研究目的和示意图相符的是( )
A.平衡体系增加O2对反应的影响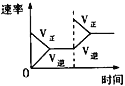
B.温度对反应的影响
C.压强对反应的影(P1>P2)
D.催化剂对反应的影响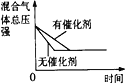
【答案】A
【解析】
A. 增大O2的量,平衡正向移动;
B. 该反应为放热反应,升高温度,平衡向放热的方向移动;
C. 增大压强,平衡向体积缩小的方向移动;
D. 加入催化剂,反应速率加快,平衡不移动。
A. 增大O2的量,平衡正向移动,图象正确,A项正确;
B. 该反应为放热反应,升高温度,平衡逆向移动,O2的转化率降低,曲线与研究目的不相符,B项错误;
C. 增大压强,反应速率加快,达到平衡所用的时间缩短,平衡正向移动,NO2的体积分数逐渐增大,曲线与研究目的不相符,C项错误;
D. 加入催化剂,反应速率加快,达到平衡所用的时间缩短,平衡不移动,曲线与研究目的不相符,D项错误;
答案选A。
改变的条件(其他条件不变) | 化学平衡移动的方向 | |||
浓度 | 增大反应物浓度或减小生成物浓度 | 向正反应方向移动 | ||
减小反应物浓度或增大生成物浓度 | 向逆反应方向移动 | |||
压强(对有气体参加的反应) | 反应前后气体体积改变 | 增大压强 | 向气体分子总数减小的方向移动 | |
减小压强 | 向气体分子总数增大的方向移动 | |||
反应前后气体体积不变 | 改变压强 | 平衡不移动 | ||
温度 | 升高温度 | 向吸热反应方向移动 | ||
降低温度 | 向放热反应方向移动 | |||
催化剂 | 同等程度改变v正、v逆,平衡不移动 | |||


科目:高中化学 来源: 题型:
【题目】I.(1)钢铁容易生锈的主要原因是钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在酸性环境下,其正极反应式为_____________;在酸性很弱或中性条件下,其发生___________________ (填“析氢腐蚀”或“吸氧腐蚀”)。
(2)利用如图装置,可以模拟铁的电化学防护。若X为碳棒,开关K置于N处,该电化学防护法称为____________________;若X为锌棒,开关K置于M处,________(填“能”或“不能”)达到防止铁腐蚀![]() 目的。
目的。
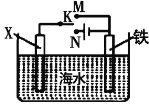
II.如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,完成下列问题:

(1)甲池燃料电池的负极反应为___________________。
(2)乙池中石墨电极为___________极,发生_____________反应(填“氧化”或“还原”)写出乙池中电解总反应的化学方程式: ___________________。
(3)甲池中消耗224mL(标准状况下)O2,此时丙池中理论上最多产生________g沉淀,此时乙池中溶液的体积为400mL,该溶液的pH=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁和高铁酸钾都是常见的水处理剂。某兴趣小组以铁屑为原料模拟工业上制备氯化铁及进一步氧化制备高铁酸钾的流程如下:

请回答下列问题:
(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是____________。
(2)“合成”阶段生成Na2FeO4的离子方程式为___________________________。
(3)为了检验“氧化”过程中所得FeCl3溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是_______(填字母)。
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液
若选用酸性KMnO4溶液进行检验,请分析方案是否合理,并说明理由:____________。
(4)常温下,若使6.4mol/LFeCl3饱和溶液不析出Fe(OH)3,需控制溶液的pH小于____。{已知该实验条件下,Ksp[(Fe(OH)3]=6.4×10-36}
(5)在不同温度和不同pH下,FeO42-的稳定性如图所示:

从上图分析,为了提高“合成”阶段Na2FeO4的产率,可采取的实验条件范围为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.由水电离产生的c(H+)=1x10-13 mol/L的溶液中:Na+、K+、Cl-、SO42-
B.室温下,pH=1的盐酸中:Na+、Fe2+、NO3-、SO42-
C.含有Ca2+的溶液中:Na+、K+、CO32-、Cl-
D.常温下在KW/ c(OH-)=10-12的溶液中:K+、Al3+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在20.00 mL 0.10 mol·L-1CH3COOH溶液中滴入0.10 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积关系如图所示。下列说法正确的是

A. T℃时,CH3COOH电离平衡常数Ka=1.0×10-3
B. M点对应的NaOH溶液体积为20.0 mL
C. N点与Q点所示溶液中水的电离程度:N>Q
D. N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )
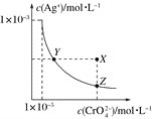
A.t℃时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t℃时,Y点和Z点时Ag2CrO4的Ksp相等
D.t℃时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,则以下说法正确的是
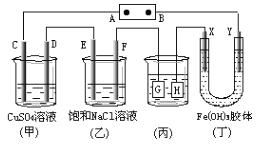
A. 电源B极是正极
B. 装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷
C. 欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D. (甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钴渗入水泥中可以制备彩色水泥(变色水泥)。以某废钴渣(主要成分为Co2O3,含少量Fe3O4、Al2O3、CaO和SiO2)制备氯化钴晶体的一种流程如下:

已知:在酸性条件下,氧化性Co3>Cl2>H2O2>Fe3+。
请回答下列问题:
(1)提高废钴渣溶解速率的措施宜采用_______(填两条)。
(2)在滤液A中加入H2O2,H2O2作还原剂的离子方程式为________________________。
(3)从滤渣B中提取铁红的操作是将滤渣B溶于过量的______________溶液(填化学式),____________,洗涤、灼烧得到铁红。
(4)从环境保护角度分析,不用浓盐酸替代硫酸的原因是__________________________。
(5)已知常温下,Ksp[Al(OH)3]≈1.0×1034。当pH=5时,c(Al3)=___________mol·L1。
(6)为了测定CoCl2nH2O中结晶水数目进行如下实验:取16.6 g样品在一定条件下脱水得13.0g CoCl2,则n=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在压强为0.1MPa、10L恒容的密闭容器中,将2molCO与5molH2的混合气体在催化剂作用下能生成甲醇CO(g)+2H2(g)=CH3OH(g)△H<0请回答下列问题:
(1)该反应的熵变ΔS_________________0(填“>”、“<”或“=”).
(2)若温度T2时,5min后反应达到平衡,CO的转化率为75%,则:
①平衡时体系总的物质的量为_________________mol
②反应的平衡常数K=_________________;
③反应0-5min在区间的平均反应速率v(H2)=_________________
(3)向反应器中再分别充入下列气体,能使CO转化率增大的是_________________
A.CO B.H2 C.CH3OH D.He
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com