
| A、容器内气体压强不再变化 |
| B、混合气体的密度恒定不变 |
| C、混合气体的颜色不再变化 |
| D、v正(H2)=v逆(HI) |


科目:高中化学 来源: 题型:
| A、医用药品应在低温、干燥的环境下密封保存 |
| B、反应中的某一物质的转化率α(B)增大,则该反应的平衡常数K一定增大 |
| C、向一堆篝火“鼓风”,有助于它继续燃烧下去 |
| D、微量的MnO2粉末可以使过氧化氢快速分解,而MnO2的质量在反应前后并没发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
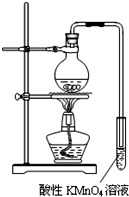 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.| 醇 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入Al粉放出H2的溶液中:Na+、K+、Fe3+、NO3- |
| B、c(Fe3+)=0.1mol/L的溶液中:NH4+、AlO2-、SO42-、HCO3- |
| C、水电离出的c(H+)=1×10-13mol/L的溶液中:Mg2+、K+、NO3-、Cl- |
| D、c(H+)=1×10-13mol/L的溶液中:K+、Cl-、AlO2-、CO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子化合物中不一定含有离子键 |
| B、单质分子中均不存在化学键 |
| C、由C元素形成的单质不一定是原子晶体 |
| D、含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是7个基本物理量之一 |
| B、18 g水在标准状况下的体积约为22.4 L |
| C、27 g Al约含有6.02×1023个铝原子 |
| D、配制0.1 mol/L的NaCl溶液需NaCl固体的质量为5.85 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属性:X<Z |
| B、原子半径:X<W<Z<Y |
| C、最高价氧化物对应水化物的酸性:W<Z |
| D、单质Y常温下能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com