
| A. | 新制氯水放在棕色试剂瓶中,避光保存 | |
| B. | 液溴密封盛放在棕色瓶中,液面上放一层水 | |
| C. | 少量金属钠保存在四氯化碳中 | |
| D. | 水玻璃保存在带胶塞的玻璃试剂瓶中 |
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:选择题
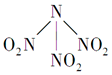 科学家最近研制出有望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
科学家最近研制出有望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )| A. | 分子中N、O间形成的共价键是非极性键 | |
| B. | 分子中4个氮原子共平面 | |
| C. | 该分子中的中心氮原子还有一对孤电子对 | |
| D. | 15.2 g该物质含有6.02×1022个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
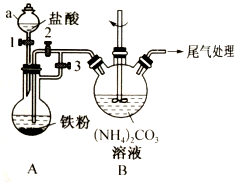 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.以下是一种制备乳酸亚铁的实验方法.
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.以下是一种制备乳酸亚铁的实验方法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业制硅:用焦炭在高温下还原二氧化硅可制得高纯硅 | |
| B. | 工业冶炼铁:需要用到的原料有铁矿石、焦炭、空气和石灰石 | |
| C. | 工业冶炼镁:电解熔融的无水氯化镁,可以得到金属镁 | |
| D. | 工业制玻璃:将石灰石、纯碱、石英在玻璃熔炉中高温熔融制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
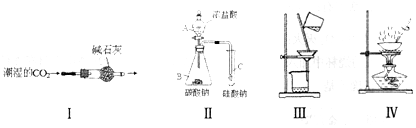
| A. | 用Ⅰ图装置,可得到干燥的CO2 | |
| B. | 用Ⅱ图装置,若C中出现白色沉淀,则可说明H2CO3的酸性强于H2SiO3 | |
| C. | 用Ⅲ图装置,可除去氯化钠溶液中的泥沙 | |
| D. | 用Ⅳ图装置,分离乙醇和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将塑料废弃物加工成防水材料或汽油,变废为宝 | |
| B. | 煤燃烧产生的烟气直接排放到空气中,易造成水体的富营养化 | |
| C. | 食品添加剂必须用天然物质制造 | |
| D. | 乙醇、过氧化氢、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定 | |
| B. | 不同的气体,若体积相同,则它们所含的分子数必相同 | |
| C. | 气体的摩尔体积是指1mol任何气体所占的体积都是22.4L | |
| D. | 恒温恒压条件下,反应前后气体的体积之比等于气体的物质的量之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
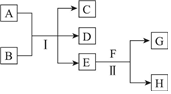 A~H为中学化学中几种常见物质,它们之间的转化关系如图所示.常温下,A和G均为单质气体,同体C常用作干燥剂,E为无色、无味的液体,F为淡黄色粉末.回答下列问题:
A~H为中学化学中几种常见物质,它们之间的转化关系如图所示.常温下,A和G均为单质气体,同体C常用作干燥剂,E为无色、无味的液体,F为淡黄色粉末.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com