
| A、Na<K<Rb |
| B、Si<P<Cl |
| C、O<S<Cl |
| D、N<P<As |
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2、H2、NH3的物质的量浓度不再改变 |
| B、nN2:nH2:nNH3=1:3:2 |
| C、N2和H2物质的量之和为NH3的2倍 |
| D、单位时间内反应1mol N2同时反应3mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2mol H2、1mol CO | 1mol CH3OH | 4mol H2、2mol CO |
| 平衡时n(CH3OH) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
| 1 |
| 2 |
| c(H2) |
| c(CH3OH2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
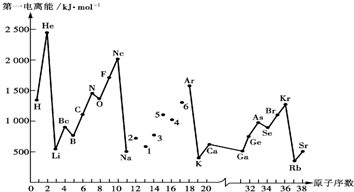
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气态电中性基态原子失去电子转化为气态基态正离子所需要的最低能量叫做第一电离能 |
| B、因为乙烯当中含有σ键,所以容易发生加成反应 |
| C、电负性的大小也可以作为判断金属性和非金属性强弱的尺度 |
| D、同主族元素从上到下第一电离能逐渐变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学活动课上,某同学分别用图示A、B两装置探究“NaHCO3和Na2CO3与稀盐酸的反应”.在相同条件下,将两个胶头滴管中的盐酸同时滴加到试管中,观察长直玻璃管内液面高低的变化.请回答下列问题:
化学活动课上,某同学分别用图示A、B两装置探究“NaHCO3和Na2CO3与稀盐酸的反应”.在相同条件下,将两个胶头滴管中的盐酸同时滴加到试管中,观察长直玻璃管内液面高低的变化.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com