
【题目】在373K 时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色,化学方程式为N2O4 ![]() 2NO2。下列条件的改变对其反应速率几乎无影响的是 ( )
2NO2。下列条件的改变对其反应速率几乎无影响的是 ( )
A. 增加NO2的物质的量 B. 将容器的体积缩小一半
C. 保持体积不变,充入N2使体系压强增大 D. 保持压强不变,充入N2使容器体积变大
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 0.1 mol·L-1的一元酸HA溶液中加入0.1 mol · L-1 NaOH溶液,HA和A- 的物质的量分数(α)随溶液pH变化的关系如图所示,下列说法正确的是:

A. pH<5.5时,c(HA)<c(A-)
B. pH>8时,c(Na+)+c(H+)>c(A-)
C. pH=7时,c(HA)>c(A-)>c(OH-)=c(H+)
D. pH=5时α(HA)与α(Aˉ)之和比pH=9时α(HA)与α(Aˉ)之和大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )

A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,将22.4LHCl溶于足量水中,溶液中含有的HCl分子数为NA
B. 常温常压下,16g14CH4所含中子数目为8NA
C. 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
D. 标准状况下,22.4L空气含有NA个单质分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作及其描述错误的是( )
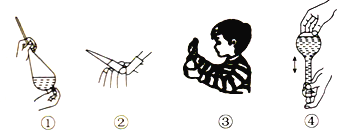
A. ①为萃取时的振荡操作,振荡过程中应打开活塞放气
B. ②为酸式滴定管排气操作,排气后记录初始读数
C. ③为闻气体气味的操作,无论有毒无毒都不能将鼻孔凑近瓶口
D. ④为配制溶液过程中摇匀的操作,摇匀后如果发现液面低于刻度线也不能再加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:

分析图像,以下结论错误的是( )
A. 析氢腐蚀和吸氧腐蚀的速率一样快
B. 在酸性溶液中生铁可能发生吸氧腐蚀
C. 溶液pH≤2时,生铁发生析氢腐蚀
D. 两溶液中负极反应均为Fe – 2e- = Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,电极Ⅰ为Zn,其他电极均为Cu。下列说法错误的是:
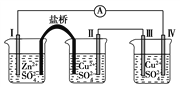
A. 电极Ⅰ发生氧化反应
B. 相同时间内,电极Ⅱ与电极Ⅳ的质量变化值相同
C. 电极Ⅲ的电极反应:4OH--4e-===O2↑+2H2O
D. 电流方向:电极Ⅳ→电流计→电极Ⅰ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)。达到平衡时,c(H2)=0.5 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 9 B. 16 C. 20 D. 25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。
I.已知硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O。一种利用硼镁矿制取金属镁及粗硼的工艺流程如下所示:

(1)硼砂中B元素的化合价为_______,将硼砂溶于热水后,用硫酸调节溶液的pH为2~3以制取H3BO3,该反应的离子方程式为____________________。X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为_____________。
(2)由MgCl2·7H2O制备MgCl2时,需要在HC1氛围中加热,其目的是________。
(3)镁-H2O2酸性燃料电池的反应原理为Mg+H2O2+2H+==Mg2++2H2O,常温下,若起始电解质溶液pH=1,则pH=2时,电解质溶液中所含Mg2+的物质的量浓度为_____________mol·L-1。已知该温度下,Ksp[Mg(OH)2]=5.6×10-12,当电解质溶液的pH=6时,_______(填“有”或“无”)Mg(OH)2沉淀析出。(忽略反应过程中溶液的体积变化)
II.工业上可用纳米MgH2和LiBH4组成的体系储放氢,如图所示。

(4)写出放氢过程中发生反应的化学方程式:____________。
III. MgO浆液是一种高活性的脱硫剂,常用于脱除烟气中的SO2,发生的主要反应如下:
①Mg(OH)2+SO2===MgSO3+H2O
②MgSO3+SO2+H2O===Mg(HSO3)2
③Mg(HSO3)2+Mg(OH)2===2MgSO3+2H2O
④2MgSO3+O2===2MgSO4
已知25℃时,Kap(MgSO3)=3.86×10-3,Kap(CaSO3)=3.1×10-7。
(5)其他条件相同时,镁基和钙基的脱硫效率与液、气摩尔流量比的变化情况如图所示。镁基的脱硫效率总比钙基的大,除生成的MgSO4具有良好的水溶性外,还因为_____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com