
【题目】X、Y、Z、W是四种短周期主族元素,X原子最外层上的电子数是原子核外电子层数的2倍;Y 原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子;Z的氢化物能与其最高价氧化物的水化物形成盐;W元素最高正价是+7价。回答下列问题:
(1)元素X原子结构示意图为________________,其周期表中的位置为__________。
(2)元素Y的一种同位素可测定文物年代,这种同位素的符号是______________。
(3)元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式为__________。
(4)ZW3可与水反应生成一种酸和一种碱,反应的化学方程式为__________。
【答案】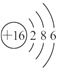 第三周期第ⅥA族 146C Cl2+SO2+2H2O═4H++2Cl-+SO42- NCl3+4H2O═3HClO+NH3H2O
第三周期第ⅥA族 146C Cl2+SO2+2H2O═4H++2Cl-+SO42- NCl3+4H2O═3HClO+NH3H2O
【解析】
X原子最外层上的电子数是原子核外电子层数的2倍,X可能为碳元素或硫元素;Y原子最外层电子数是次外层电子数的2倍,说明Y只有2个电子层,且最外层有4个电子,Y为碳元素;Z的氢化物能与其最高价氧化物的水化物形成盐,因此Z为氮元素;W的最高正价为+7,而F元素无正价,因此W为氯元素,综上得X、Y、Z、W分别为S、C、N、Cl。
(1)X为硫元素,原子结构示意图为: ,电子层数等于周期数,最外层电子数等于主族序数,则硫元素位于第三周期第ⅥA族;
,电子层数等于周期数,最外层电子数等于主族序数,则硫元素位于第三周期第ⅥA族;
(2)碳的放射性同位素146C可用于考古;
(3)Cl2与SO2在水溶液中反应离子方程式为:Cl2+SO2+2H2O═4H++2Cl-+SO42-;
(4)NCl3与H2O反应生成物中有碱,只能是NH3H2O,N为-3价,Cl为+1价,酸应为HClO,反应方程式为:NCl3+4H2O═3HClO+NH3H2O。


科目:高中化学 来源: 题型:
【题目】用电解法处理含Cr2O72-的废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是
实验 | i | ii | iii | iv |
|
是否加入Fe2(SO4)3 | 否 | 否 | 加入30g | 否 | |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL | |
阴极村料 | 石墨 | 石墨 | 石墨 | 石墨 | |
阳极材料 | 石墨 | 石墨 | 石墨 | 铁 | |
Cr2O72-的去除率 | 0.092% | 12.7% | 20.8% | 57.3% | 实验iii中Fe3+去除Cr2O72-的机理 |
A. 实验ⅱ与实验i对比,其他条件不变,增加c(H+)有利于Cr2O72-的去除
B. 实验ⅲ与实验ⅱ对比,其他条件不变,增加c(Fe3+)有利于Cr2O72-的去除
C. 实验ⅳ中Fe2+循环利用提高了Cr2O72-的去除率
D. 若实验ⅳ中去除0.01 mol Cr2O72-,生成的阳离子全部转化成沉淀,则沉淀的质量是2.06g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O],流程设计如下:
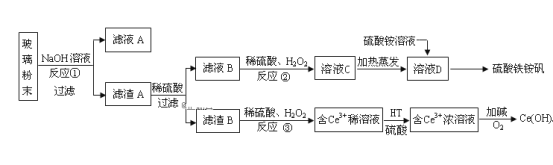
已知:Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答以下问题:
(1)滤渣A的主要成分是___。
(2)反应②中H2O2的作用是___。
(3)反应③的离子方程式是___。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+(水层)+6HT(有机层)![]() 2CeT3 (有机层)+ 6H+(水层)。从平衡角度解释:向CeT3(有机层)加入H2SO4 获得较纯的含Ce3+的水溶液的原因是___。
2CeT3 (有机层)+ 6H+(水层)。从平衡角度解释:向CeT3(有机层)加入H2SO4 获得较纯的含Ce3+的水溶液的原因是___。
(5)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:mA(g)+nB(g)![]() pC(g)+qD(g) ΔH=?,反应物A的转化率随时间和温度的变化如下图所示,下列判断正确的是
pC(g)+qD(g) ΔH=?,反应物A的转化率随时间和温度的变化如下图所示,下列判断正确的是

A. 由图b可知,ΔH<0
B. 图a中要使平衡状态Ⅱ到平衡状态Ⅰ,可以加入催化剂
C. 若m+n>p+q,则由状态Ⅱ到状态Ⅰ可以压缩容器体积
D. 在不同的平衡状态Ⅰ和Ⅱ时,化学平衡常数一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.甲同学用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2·xH2O)并测量其结晶水含量。已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。制取流程如下:

请回答下列问题:
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A中Fe2+的试剂为________(填编号)。
①KMnO4 ②K3[Fe(CN)6] ③NaOH ④KSCN
(2)试剂①是________,试剂②是________。(填化学式)
(3)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x的值,某兴趣小组设计了以下实验方案:
称取m g晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得黑色固体的质量为n g。沉淀洗涤的操作方法是________,根据实验数据测得x=________(用含m、n的代数式表示)。
Ⅱ.乙同学设计了一套电解饱和食盐水的实验装置,来验证氯气的某些性质和测定产生的氢气的体积。
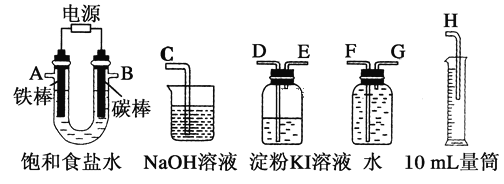
(4)所选仪器接口的连接顺序是A接________,________接________;B接________,________接________。
(5)若装入的饱和食盐水为75 mL(氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为8.4 mL(已转换成标准状况下的体积)时停止通电。将U形管内的溶液倒入烧杯,常温时测得溶液的pH约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 用酸性高锰酸钾溶液可以鉴别己烯、甲苯和苯
B. 聚乳酸分子如图,该分子中存在酯基、羧基、羟基

C. 蛋白质和油脂都属于高分子化合物,一定条件下都能水解
D. 有机物CH3CO18OH和C2H5OH在浓硫酸催化作用下产物为CH3CO18OC2H5和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质的电子式或用电子式表示形成过程。
Ⅰ.写出下列物质的电子式
(1)NH4Cl___________
(2)Na2O2___________
Ⅱ.用电子式表示形成过程
(1)CaBr2:_________________
(2)K2O:__________________
(3)CO2:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaClO3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为 。
(4)“操作1”中包含3个基本实验操作,它们依次是 、 和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是 。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是 ;其使用的最佳pH范围是 。

A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是( )
A.原子数相等的三种气体,质量最大是Z
B.若一定条件下,三种气体体积均为2.24L,则他们的物质的量一定均为0.1mol
C.同温同压下,同质量的三种气体,气体密度最小的是X
D.同温下,体积相同的两容器分别充2gY气体和1gZ气体,则压强比为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com