
M是一种治疗直肠癌和小细胞肺癌药物的主要成分,其结构式为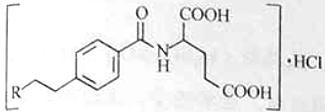 (不考虑立体结构,其中R为
(不考虑立体结构,其中R为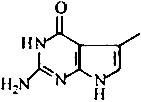 )。M的一条合成路线如下(部分反应试剂和条件略去)。
)。M的一条合成路线如下(部分反应试剂和条件略去)。
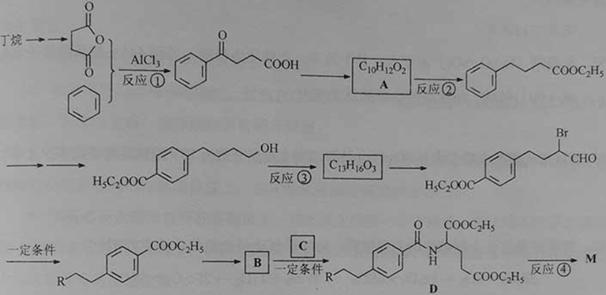
完成下列填空:
1.写出反应类型。 反应①_________ 反应③__________
2.写出反应试剂和反应条件。反应②_________ 反应④__________
3.写出结构简式。 B_____________ C_____________
4.写出一种满足下列条件的A的同分异构体的结构简式。
(1)能与FeCl3溶液发生显色反应;(2)能发生银镜反应;(3)分子中有5种不同化学环境的氢原子。
5.丁烷氯代可得到2-氯丁烷,设计一条从2-氯丁烷合成1,3-丁二烯的合成路线。
(合成路线常用的表示方法为:A B……
B……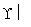 目标产物)
目标产物)
6.已知:R-CO-NHR′与R-CO-OR′的化学性质相似。
从反应④可得出的结论是:_______________________。
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
以下烃中,一氯代物只有一种的是 ( )
A.CH3 CH2 CH2 CH2CH3 B.CH3CH2CH3 C. CH3CH2CH2CH3 D.C(CH3)4
查看答案和解析>>
科目:高中化学 来源: 题型:
1,3-丁二烯和2-丁炔分别与氢气反应的热化学方程式如下:
CH2=CH-CH=CH2(g)+2H2(g)→CH3CH2CH2CH3(g)+236.6kJ
CH3-C≡C-CH3(g)+2H2(g)→CH3CH2CH2CH3(g)+272.7kJ
由此不能判断
A.1,3-丁二烯和2-丁炔稳定性的相对大小
B.1,3-丁二烯和2-丁炔分子储存能量的相对高低
C.1,3-丁二烯和2-丁炔相互转化的热效应
D.一个碳碳叁键的键能与两个碳碳双键的键能之和的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,0.1mol/L的硫化钠溶液和0.1mol.L的碳酸钠溶液,碱性更强的是_______,其原因是________。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15
H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用电石-乙炔法生产乙烯的反应如下:
CaO+3C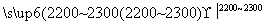 CaC2+CO
CaC2+CO
CaC2+2H2O→HC≡CH↑+Ca(OH)2
HC≡CH↑+HCl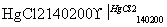 CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖于石油资源。
电石-乙炔法的缺点是___________________、_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
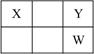
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如右下图所示,下列说法一定正确的是
A.最高价氧化物对应水化物的酸性最强的是W
B.Y与Z只能形成一种化合物
C.简单阴离子还原性:Y>W
D.Z与Q形成的化合物水溶液可能显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
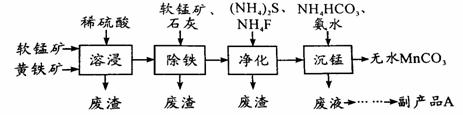
回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有(写一条) 。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是(用离子方程式表示) 。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol•L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕,
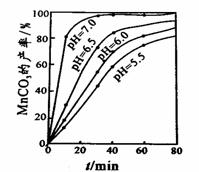 (4)沉锰工序中,298K、c(Mn2+)为1.05 mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如右图所示。根据图中信息得出的结论是 。
(4)沉锰工序中,298K、c(Mn2+)为1.05 mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如右图所示。根据图中信息得出的结论是 。
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是___________ 。
(6)从沉锰工序中得到纯净MnCO3的操作方法是
,沉锰工序中怎样证明MnCO3已经洗涤干净
,副产品A的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,根据电化学原理可进行如下处理,在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去,下列说法正确的是 ( )
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al+3Ag2S===6Ag+Al2S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com