
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.61 | 2.04 | 1.57 | 2.55 | 3.16 | 3.98 | 0.98 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.31 | 3.04 | 0.93 | 3.44 | 2.19 | 2.58 | 1.90 |
| 锂 | X | Y | |
| 失去第1个电子 | 519 | 502 | 580 |
| 失去第2个电子 | 7296 | 4570 | 1820 |
| 失去第3个电子 | 11799 | 6920 | 2750 |
| 失去第4个电子 | 9550 | 11600 |
分析 (1)①从同周期元素自左到右排列,然后结合数据分析;
②同主族自上而下,电负性逐渐减小;
③根据溴元素和铝元素的电负性差值判断;
(2)①锂原子核外共有3个电子,其中两个在K层,1个在L层,当失去最外层的一个电子后,锂离子处于稳定结构;
②由表中数据可知,X的第二电离能剧增,故X表现+1价,处于第ⅠA族,且第一电离能比Li的小,说明比锂的金属性强,应为上述元素中的Na元素;由表中数据可知,Y的第四电离能剧增,故Y表现+3价,最外层电子数为3,应为ⅢA族元素,应为上述元素中的Al,处于零族元素已达8e-的稳定结构,因此失去核外第一个电子需要的能量最多.
解答 解:(1)①由表中数据可知,第二周期元素从Li~F随着原子序数的递增,元素的电负性逐渐增大,第三周期由Na~S,随着原子序数的递增,元素的电负性也逐渐增大,并呈周期性变化,且同主族元素从上到下随着原子序数的递增电负性逐渐减小;故答案为:增大;减小;
②电负性Br>I;电负性最小的元素在周期表中位置处于左下角的金属性最强的元素,应在第6周期第ⅠA族;故答案为:>;第6周期ⅠA族;
③AlBr3中,Al电负性为1.61,Br电负性小于Cl的电负性3.16,故二者差值小于1.7,故AlBr3中化学键类型为共价键;故答案为:共价键;
(2)①锂原子核外共有3个电子,其中2个电子在K层,1个电子在L层,当失去最外层的一个电子后,锂离子处于稳定结构,根据题中所给信息可知要使锂离子再失去电子会形成不稳定结构,故锂原子失去第二个电子时所需能量远大于失去第一个电子所需的能量;故答案为:Li原子失去1个电子后形成稳定结构再失1个电子困难;
②由表中数据可知,X的第二电离能远远大于其第一电离能,故X应为+1价,故X处于第ⅠA族,且第一电离能小于Li,则X金属性强于Li,故X应为Na元素;Y的第四电离能剧增,故应表现+3价,则应位于第ⅢA族,应为Al元素;第3周期元素中,元素原子失去核外第一个电子需要的能量最多,即为本身已达稳定结构,故应为Ar,故答案为:Na;Al;Ar.
点评 本题考查了电负性的含义和应用,难度不大,一般情况下电负性的变化规律与元素非金属性的变化规律一致.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:解答题
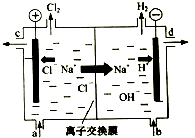 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯在强碱性环境下水解:CH3CO18OC2H5+OH-$\stackrel{△}{→}$ CH3COO -+C2H518OH | |
| B. | 苯酚钠溶液中通入二氧化碳:2C6H5O-+CO2+H2O $\stackrel{△}{→}$ C6H5OH+CO32- | |
| C. | 醋酸溶液与氢氧化铜反应:2CH3COOH+Cu(OH)2═Cu2++2CH3COO-+2H2O | |
| D. | 溴乙烷在氢氧化钠水溶液中的反应:CH3CH2Br+OH-$\stackrel{△}{→}$CH3CH2OH+Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水可以区分苯和CCl4 | |
| B. | 有机物分子中都存在碳碳单键 | |
| C. | 做银镜反应实验后的试管内壁附有银,可用稀盐酸清洗 | |
| D. | 检验乙醇消去后的产物乙烯,可将气体直接通入酸性高锰酸钾溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
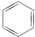 ③(CH3)2C=CH2④
③(CH3)2C=CH2④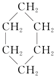 ⑤
⑤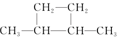
| A. | 链状烃:①③⑤ | B. | 链状烃:③⑤ | C. | 环状烃:②④⑤ | D. | 芳香烃:②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与金属钠反应时,是乙醇分子中羟基中的O-H键断裂 | |
| B. | 检验乙醇中是否含有水,可加入少量无水硫酸铜,若变蓝则含水 | |
| C. | 向待测液中加入饱和碳酸钠溶液鉴别乙酸、乙酸乙酯、乙醇 | |
| D. | 向苯和苯酚混合溶液中滴加过量浓溴水除去混合溶液中的苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉与氧化镁共热可制取金属镁 | |
| B. | 铝分别与足量的 HCl溶液、足量的NaOH的溶液反应,产生的氢气前者多 | |
| C. | 可用Na2SiO3溶液和CO2反应来制备H2SiO3 | |
| D. | NaOH溶液可以盛装在带玻璃塞的磨口试剂瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com