
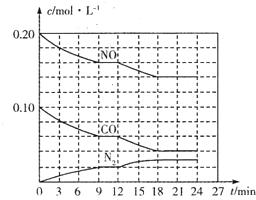
 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.分析 (1)已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
又知C和CO的燃烧热(△H)分别为-393.5kJ•mol-1和-283kJ•mol-1
可得热化学方程式:②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1
根据盖斯定律,③×2-①可得:2NO(g)+2CO(g)═N2(g)+2CO2(g);
(2)①根据v=$\frac{△c}{△t}$计算v(CO);
12min时改变条件瞬间各组分浓度不变,而氮气浓度增大,NO、CO浓度减小,平衡正向移动,结合平衡移动原理分析解答;
②由①中可知12min时为改变温度,重新到达平衡时NO为0.14mol/L、CO为0.04mol/L、氮气为0.03mol/L,由方程式可知二氧化碳为0.06mol/L,二氧化碳条件分数=$\frac{平衡时二氧化碳浓度}{混合气体总浓度}$×100%,根据K=$\frac{c({N}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$计算平衡常数;
(3)混合后溶液中c(Ba2+)=0.5b mol/L,根据电荷守恒:2c(Ba2+)+c(H+)=c(CH3COO-)+c(OH-),溶液中存在2c(Ba2+)=c(CH3COO-),则c(H+)=c(OH-)=10-7 mol/L,溶液中c(CH3COO-)=b mol/L,由微粒守恒可知溶液中c(CH3COOH)=(0.5a-b )mol/L,再根据Ka=$\frac{c({H}^{+})×c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$计算;
(4)利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量,反应前后气体体积不变,用物质的量代替浓度代入K=$\frac{{c}^{2}(NO)}{c({N}_{2})×c({O}_{2})}$计算平衡常数,温度相同,则平衡常数相同;
令N2转化的物质的量为xmol,利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量,再根据平衡常数列方程计算解答.
解答 解:(1)已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
又知C和CO的燃烧热(△H)分别为-393.5kJ•mol-1和-283kJ•mol-1
可得热化学方程式:②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1
根据盖斯定律,③×2-①可得:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5KJ/mol
故答案为:-746.5;
(2)①0-9min内CO浓度变化为(0.1-0.06)mol/L=0.04mol/L,则v(CO)=$\frac{0.04mol/L}{9min}$=4.4×10-3L-1•min-1,
12min时改变条件瞬间各组分浓度不变,而氮气浓度增大,NO、CO浓度减小,平衡正向移动,正反应为放热反应,应是降低温度,
故答案为:4.4×10-3;D;
②由①中可知12min时为改变温度,重新到达平衡时NO为0.14mol/L、CO为0.04mol/L、氮气为0.03mol/L,由方程式可知二氧化碳为0.06mol/L,二氧化碳条件分数=$\frac{0.06}{0.14+0.04+0.03+0.06}$×100%=22.2%,平衡常数K=$\frac{c({N}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$=$\frac{0.03×0.0{6}^{2}}{0.1{4}^{2}×0.0{4}^{2}}$=3.4,
故答案为:22.2%;3.4;
(3)混合后溶液中c(Ba2+)=0.5b mol/L,根据电荷守恒:2c(Ba2+)+c(H+)=c(CH3COO-)+c(OH-),溶液中存在2c(Ba2+)=c(CH3COO-),则c(H+)=c(OH-)=10-7 mol/L,溶液中c(CH3COO-)=b mol/L,由微粒守恒可知溶液中c(CH3COOH)=(0.5a-b )mol/L,电离平衡常数Ka=$\frac{c({H}^{+})×c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{1{0}^{-7}×b}{(0.5a-b)}$=$\frac{2b}{a-2b}$×10-7 mol•L-1,
故答案为:$\frac{2b}{a-2b}$×10-7 mol•L-1;
(4)在T温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,
则参加反应氮气为2mol×$\frac{1}{2}$=1mol,
N2(g)+O2(g)?2NO(g)
起始(mol):10 5 0
反应(mol):1 1 2
平衡(mol):9 4 2
所以平衡常数K=$\frac{{c}^{2}(NO)}{c({N}_{2})×c({O}_{2})}$=$\frac{{2}^{2}}{9×4}$=$\frac{1}{9}$
令N2转化的物质的量为xmol,则
N2(g)+O2(g)?2NO(g)
起始(mol):1 1 0
反应(mol):x x 2x
平衡(mol):1-x 1-x 2x
所以$\frac{(2x)^{2}}{(1-x)×(1-x)}$=$\frac{1}{9}$,解得x=$\frac{1}{7}$,
N2的转化率为$\frac{\frac{1}{7}mol}{1mol}$×100%=14.3%.
故答案为:14.3%.
点评 本题考查化学平衡计算与影响因素、反应速率、平衡常数应用、反应热计算、电离平衡常数等,属于拼合型题目,需学生具备扎实的基础,难度中等.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某烷烃命名为2,3,4-三甲基-3,5-二乙基己烷 | |
| B. | 结构片段为 的高聚物,是其单体通过缩聚反应生成 的高聚物,是其单体通过缩聚反应生成 | |
| C. | 所有的糖、油脂、蛋白质都能水解,但水解产物不同 | |
| D. | 醋酸和硬脂酸互为同系物,C2H6和C9H20也一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20ml 0.1mol/L 酒石酸(用H2T表示)溶液中逐渐滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是( )
常温下,向20ml 0.1mol/L 酒石酸(用H2T表示)溶液中逐渐滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图关系,下列说法正确的是( )| A. | HT-在溶液中水解程度大于电离程度 | |
| B. | 当V(NaOH)=20mL时,溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=30mL时,溶液中存在c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+) | |
| D. | 当V(NaOH)=40ml时,溶液中存在c(OH-)=c(HT-)+2 c(H2T)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素的原子半径由小到大的顺序为:r(X)<r(Z)<r(W)<r(Y). | |
| B. | X、Y、Z既能形成离子化合物,又能形成共价化合物 | |
| C. | X与其余三种元素之间形成的核外电子总数为10的微粒只有2种 | |
| D. | H2Z的熔点比H2W高,是因为它们的晶体类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纪录片《穹顶之下》中的雾霾属于小颗粒纳米级聚合物,我们可利用丁达尔现象鉴别 | |||||||
| B. | 安装煤炭“固硫”、“脱硝”装置,可以有效避免“穹顶”出现的概率 | |||||||
| C. | 我国是煤多油少的国家,煤层气俗称瓦斯气,是一种新利用的能源,煤层气相比直接烧煤更清洁,利于对抗雾霾 | |||||||
| D. | 下表为全国主要机场机场2014年PM2.5均值,PM2.5口罩材质为碳纤维毡垫、高分子织物、无纺布等,是一种间隙比半透膜还小的分子筛.
|
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
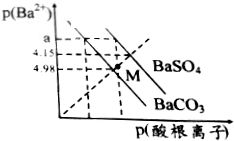 已知:p(Ba2+)=-lgc(Ba2+),p(酸根离子)=-lgc(酸根离子),酸根离子为SO42-或CO32-.某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,下列叙述正确的是( )
已知:p(Ba2+)=-lgc(Ba2+),p(酸根离子)=-lgc(酸根离子),酸根离子为SO42-或CO32-.某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,下列叙述正确的是( )| A. | p(Ba2+)=a时,溶液中所含的c(SO42-)>c(CO32-) | |
| B. | M点对应溶液中的Ba2+、CO32-能形成BaCO3沉淀 | |
| C. | 由图可知该温度下,KSP(BaSO4)<KSP(BaCO3) | |
| D. | BaSO4淀不能转化为BaCO3沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com