
| A. | CH4和C2H4 | B. | C2H4和C3H4 | C. | C2H4和C2H6 | D. | C3H6和C2H4 |
分析 密度与摩尔质量成正比,混合烃对H2的相对密度为17,据此可以计算出混合烃的平均摩尔质量,然后设出混合烃的平均分子式,根据差量法计算出平均H原子数,再根据平均摩尔质量计算出含有的平均C原子数,结合选项判断.
解答 解:(1)设混合烃的平均分子式为:CxHy,密度与摩尔质量成正比,混合烃对H2的相对密度为17,则混合烃的平均摩尔质量为:17g/mol×2=34g/mol,则12x+y=34,
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O 体积减小△n
1 x+$\frac{y}{4}$ x 1+$\frac{y}{4}$
10mL (10+80-70)=20mL
所以(1+$\frac{y}{4}$):1=20mL:10mL,解得:y=4,
将y=4代入12x+y=34,可得x=2.5,
所以混合气体的平均组成为:C2.5H4,
A.CH4和C2H4混合平均碳原子数目介于1~2之间,小于2.5,故A错误;
B.C2H4和C3H4以任意比混合满足平均H原子数目为4,二者为1:1混合时,平均碳原子数目为2.5,故B正确;
C.C2H4和C2H6混合平均H原子数目大于4,平衡碳原子数目为2,不符合题意,故C错误;
D.C3H6和C2H4混合平均H原子数目大于4,不符合题意,故D错误.
故选:B.
点评 本题考查有关混合物反应的计算,题目难度中等,掌握根据平均分子式确定混合烃的组成,试题培养了学生的分析能力及化学计算能力.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有乙烯 | B. | 一定没有乙烯 | C. | 一定有甲烷 | D. | 一定有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的NaHSO3与Na2SO3混合溶液中:c(Na+)=c(HSO3-)+c(SO32-) | |
| B. | 等物质的量浓度的下列溶液中:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4 ④NH3•H2O,c(NH4+)由大到小的顺序是①>②>③>④ | |
| C. | 0.1 mol•L-1的醋酸的pH=a,0.01 mol•L-1的醋酸的pH=b,则a+1=b | |
| D. | 0.1 mol•L-1的醋酸钠溶液20 mL与0.1 mol•L-1的盐酸10 mL混合后溶液显酸性,则有:c(CH3COOH)>c(H+)>c(Cl-)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:MnO2+2H2O+2e-=Mn(OH)2+2OH- | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器中NH3的物质的量一定增加了0.30mol | |
| B. | 容器中H2O(g)的物质的量至少为0.45mol | |
| C. | NH3的平均反应速率为0.010mol/(L•s) | |
| D. | NH3、O2、NO、H2O的物质的量之比一定为4:5:4:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

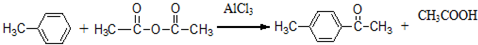
 .
. .
. .
.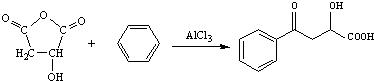 .
.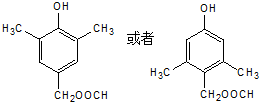 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
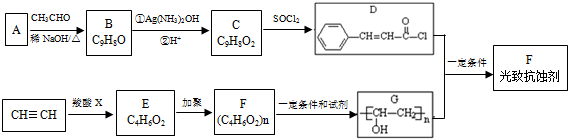
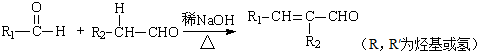
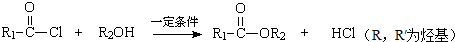
 .
.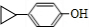 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com