
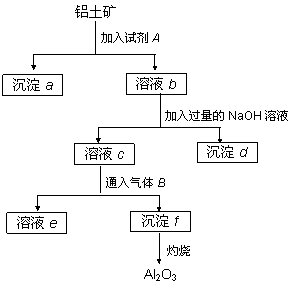
铝土矿的主要成分是Al2O3,含有Fe2O3、SiO2等杂质,按下列操作从铝土矿中提取Al2O3。回答下列问题
(1)沉淀物的化学式分别是:
a ;d ;f 。
(2)写出加入过量NaOH溶液时所发生主要反应的离子方程式__________________________________________________________
(3)写出通入气体B(过量)时溶液c中发生反应的离子方程式
____________________________________________________________________
(4) 气体B能否改用试剂A代替?为什么?
______________________________________________________________________
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
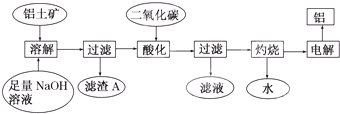
 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、赤铁矿的主要成分是Fe2O3 | B、铝土矿的主要成分是Al2O3 | C、工业制备氯气主要采用电解饱和食盐水的方法 | D、把铁矿石冶炼成铁的过程中,还原剂主要是焦炭 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com