
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A.含有相同铜原子数的Cu2S和CuO的质量相等B.2g氢气所含质子数目为NA
C.lmol氨气含有的原子数目为2NAD.22.4LCH4所含电子数目为l0NA
科目:高中化学 来源: 题型:
【题目】铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)铁原子外围电子轨道表示式为____________________,铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用_________摄取铁元素的原子光谱。
(2)FeCoOx是一种新型光电催化剂。第四电离能大小关系是I4(Co)____I4(Fe)(填“>”或“<” ) ,原因是_____________。
(3)二茂铁[(C5H5)2Fe]可用作火箭燃料添加剂、汽油抗爆剂。二茂铁熔点172℃,沸点249 ℃,易升华,难溶于水,易溶于有机溶剂,它属于_____________晶体。
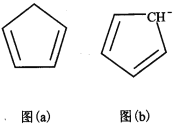
(4)环戊二烯(C5H6)结构如图(a),可用于制二茂铁。环戊二烯中碳原子的杂化方式为________。分子中的大π键可用符号![]() 表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H5―)结构如图(b),其中的大π键可以表示为_________________。
表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H5―)结构如图(b),其中的大π键可以表示为_________________。
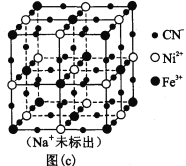
(5)某普鲁士蓝类配合物可作为新型钠离子电池电极材料。它由Na+、Ni2+、Fe3+和CN―构成,其晶胞结构如图(c)。该物质中,不存在________(填标号)。A.离子键 B. σ键 C. π键 D. 氢键 E. 金属键
(6)该晶胞中Fe3+采用的堆积方式与_______(选填Po、Na、Mg、Cu)相同,单个晶胞的配位空隙中共容纳_____个 Na+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氨或铵盐的说法不正确的是
A. 可用湿润的红色石蕊试纸检验氨气
B. 用盐酸滴定氨水,当溶液呈中性时,c(NH4+) = c(Cl)
C. NH3属于弱电解质
D. 常温时,0.1 mol·L1NH4Cl溶液加水稀释,![]() 的值不变
的值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在科研、生活等方面有广泛用途。如图所示为从海带中制取碘的工艺流程。
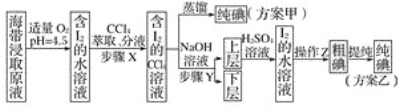
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
请回答下列问题:
(1)分液漏斗使用前需要检漏,检漏方法为__________。
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________。
(3)下列有关步骤Y的说法中正确的是_____(填字母)。
A.应控制NaOH溶液的浓度和体积
B.将碘单质转化成碘离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以用乙醇代替
(4)向“上层”中加入H2SO4溶液,发生反应的化学方程式为____,操作Z的名称为________。
(5)方案甲中采用蒸馏不合理,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】八种短周期元素原子半径的相对大小、最高正价或最低负价如图所示,下列说法错误的是()
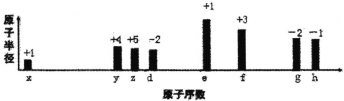
A.常见的离子半径:g>h>d>e
B.氢化物的沸点y 一定低于z
C.由d、e、g三种元素组成的盐和稀硫酸反应可能生成沉淀
D.e、f、h的最高价氧化物的水化物之间可两两反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需用500mL0.1mol/L的硫酸铜溶液,现选取500mL容量瓶进行配制,有关以下操作正确的是()
A.称取8.0g硫酸铜固体,加入500mL水
B.配制好的硫酸铜溶液应转移到细口试剂瓶中,并贴上标签
C.滴加蒸馏水不慎超过刻度线,立即用胶头滴管将多余的液体
D.定容摇匀后,发现配制溶液液面低于刻度线,应用胶头滴管滴加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市售盐酸试剂瓶标签上的部分信息如下:
盐酸
分子式:HCl
相对分子质量:36.5
密度约1.18 g·mL-1
HCl的质量分数:36.5%
(1)该盐酸的物质的量浓度c(HCl)=__ mol·L-1。
(2)取该盐酸50 mL加水稀释到500 mL,则稀释后溶液中(HCl)= ___mol·L-1。
(3)取稀释后盐酸溶液100mL,该溶液中所含的氯离子的个数为:N(Cl—)=___NA
(4)取稀释后的适量盐酸与足量的锌粒作用,生成0.25 mol氢气,在标准状况下气体的体积是___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)与氮、磷同一主族,可以形成As4、As2S3、As2O5、H3AsO3、H3AsO4等物质,有着广泛的用途。回答下列问题:
(1)As原子最外层电子的电子云伸展方向有___种。黄砷(As4)与白磷(P4)的结构类似,以下关于黄砷与白磷的比较叙述正确的是___(填编号)。
A.黄砷的熔点高于白磷 B.黄砷中共价键键能大于白磷
C.黄砷分子极性大于白磷 D.分子中共价键键角均为109°28′
(2)As元素的非金属性比N弱,用原子结构的知识说明理由。___。
(3)298K时,将20mL3xmol/LNa3AsO3、20mL3xmol/LI2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。
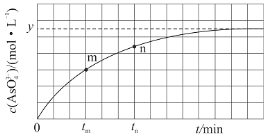
①若平衡时,pH=14,该反应的平衡常数为___。
②当反应达到平衡时,下列选项正确的是__(填标号)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.![]() 不再变化 d.c(I-)=ymol/L
不再变化 d.c(I-)=ymol/L
③tm时,v正__v逆(填“大于”“小于”或“等于”)。
④tm时,v逆__tn时v逆(填“大于”“小于”或“等于”),理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。
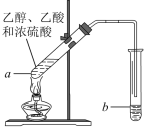
(1) 用化学方法可以鉴别乙醇和乙酸的试剂是______________(填字母);
a.稀硫酸 b.酸性KMnO4溶液
c.NaOH溶液 d.紫色的石蕊溶液
(2) 试管a中加入几块碎瓷片的目的是______________;
(3) 为了研究乙醇与乙酸反应的机理,若将乙醇中的氧原子用18O标记,写出标记后试管a中发生反应的化学方程式:_________________________________________ ;其反应类型是______________;
(4) 反应开始前,试管b中盛放的溶液是_____________ ;
(5) 反应结束后,常用____________操作把试管b中合成的酯分离出来。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com