
”¾ĢāÄæ”æŅŃÖŖĻĀĆęČżøöŹż¾Ż£ŗ7.2”Į10£4”¢4.6”Į10£4”¢4.9”Į10£10·Ö±šŹĒĻĀĮŠÓŠ¹ŲµÄČżÖÖĖįµÄµēĄė³£Źż£¬ČōŅŃÖŖĻĀĮŠ·“Ó¦æÉŅŌ·¢Éś£ŗ
NaCN£«HNO2===HCN£«NaNO2
NaCN£«HF===HCN£«NaF
NaNO2£«HF===HNO2£«NaF
ÓÉ“ĖæÉÅŠ¶ĻĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ (””””)
A. K(HF)£½7.2”Į10£4 B. K(HNO2)£½4.6”Į10£4
C. øł¾ŻĘäÖŠČĪŅāĮ½øö·“Ó¦¼“æÉµĆ³ö½įĀŪ D. K(HCN)<K(HNO2)<K(HF)
”¾“š°ø”æC
”¾½āĪö”æøł¾ŻĒæĖįÖĘČõĖįµÄø“·Ö½ā·“Ó¦ŌĄķ£¬ÓÉ·“Ó¦NaCN£«HNO2=HCN£«NaNO2µĆ³öĖįŠŌHNO2![]() HCN£¬ÓÉ·“Ó¦NaCN£«HF=HCN£«NaFµĆ³öĖįŠŌHF
HCN£¬ÓÉ·“Ó¦NaCN£«HF=HCN£«NaFµĆ³öĖįŠŌHF![]() HCN£¬ÓÉ·“Ó¦NaNO2£«HF=HNO2£«NaFµĆ³öĖįŠŌHF
HCN£¬ÓÉ·“Ó¦NaNO2£«HF=HNO2£«NaFµĆ³öĖįŠŌHF![]() HNO2£¬ŌņĖįŠŌHF
HNO2£¬ŌņĖįŠŌHF![]() HNO2
HNO2![]() HCN£¬ĖįŠŌŌ½ĒæµēĄėĘ½ŗā³£ŹżŌ½“ó£¬ŌņK(HCN)<K(HNO2)<K(HF)£¬K£ØHF£©=7.2
HCN£¬ĖįŠŌŌ½ĒæµēĄėĘ½ŗā³£ŹżŌ½“ó£¬ŌņK(HCN)<K(HNO2)<K(HF)£¬K£ØHF£©=7.2![]() 10-4£¬K£ØHNO2£©=4.6
10-4£¬K£ØHNO2£©=4.6![]() 10-4£¬K£ØHCN£©=4.9
10-4£¬K£ØHCN£©=4.9![]() 10-10£¬A”¢B”¢DĻī¾łÕżČ·£»øł¾ŻµŚ1øöŗĶµŚ3øö·“Ó¦æÉŅŌµĆ³ö½įĀŪ£¬½öÓɵŚ1øöŗĶµŚ2øö»ņµŚ2øöŗĶµŚ3øö·“Ó¦²»ÄÜµĆ³ö½įĀŪ£¬CĻī“ķĪ󣻓š°øŃ”C”£
10-10£¬A”¢B”¢DĻī¾łÕżČ·£»øł¾ŻµŚ1øöŗĶµŚ3øö·“Ó¦æÉŅŌµĆ³ö½įĀŪ£¬½öÓɵŚ1øöŗĶµŚ2øö»ņµŚ2øöŗĶµŚ3øö·“Ó¦²»ÄÜµĆ³ö½įĀŪ£¬CĻī“ķĪ󣻓š°øŃ”C”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµČĪļÖŹµÄĮæµÄX(g)ÓėY(g)ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠæÉÄę·“Ó¦£ŗX(g)£«Y(g) ![]() 2Z(g)£«W(s)””¦¤H£¼0£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ””””£Ø””””””£©
2Z(g)£«W(s)””¦¤H£¼0£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ””””£Ø””””””£©
A. Ę½ŗā³£ŹżKÖµŌ½“ó£¬XµÄ×Ŗ»ÆĀŹŌ½“ó
B. “ļµ½Ę½ŗāŹ±£¬·“Ó¦ĖŁĀŹvÕż(X)£½2vÄę(Z)
C. “ļµ½Ę½ŗāŗó½µµĶĪĀ¶Č£¬ÕżĻņ·“Ó¦ĖŁĀŹ¼õŠ”µÄ±¶Źż“óÓŚÄęĻņ·“Ó¦ĖŁĀŹ¼õŠ”µÄ±¶Źż
D. “ļµ½Ę½ŗāŗó£¬ÉżøßĪĀ¶Č»ņŌö“óŃ¹Ē涼ӊĄūÓŚøĆ·“Ó¦Ę½ŗāĻņÄę·“Ó¦·½ĻņŅʶÆ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĆę¶ŌĶ»ČēĘ䥓µÄŠĀ¹Ś²”¶¾£¬Ō½Ą“Ō½¶ąµÄČĖŅāŹ¶µ½Ń§Ļ°»ÆѧµÄÖŲŅŖŠŌ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A.Ņ½ÓĆ¾Ę¾«Ćš»īŠĀ¹Ś·ĪŃײ”¶¾ŹĒĄūÓĆĘäŃõ»ÆŠŌ
B.N95æŚÕÖĖłŹ¹ÓĆµÄ¾Ū±ūĻ©²ÄĮĻŹōÓŚŗĻ³ÉĻĖĪ¬
C.ĪŖŌöĒæ”°84”±Ļū¶¾ŅŗµÄĻū¶¾Š§¹ū£¬æɼÓČėĻ”ŃĪĖį
D.ĪŅ¹śŃŠÖʵÄÖŲ×éŠĀ¹ŚŅßĆēĪŽŠčĄä²Ų±£“ę
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŗ£Ė®ŹĒÖŲŅŖµÄĖ®×ŹŌ“”£ĻĀĮŠ·½·ØæÉÓĆÓŚµ»Æŗ£Ė®µÄŹĒ
A.ÕōĮó·ØB.¹żĀĖ·ØC.·ÖŅŗ·ØD.ŻĶČ”·Ø
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ100”ꏱ£¬½«0.1 mol N2O4ÖĆÓŚ1LĆܱյÄÉÕĘæÖŠ£¬Č»ŗó½«ÉÕĘæ·ÅČė100”ę µÄŗćĪĀ²ŪÖŠ£¬ÉÕĘæÄŚµÄĘųĢåÖš½„±äĪŖŗģ×ŲÉ«£ŗN2O4(g)![]() 2NO2 (g)”£
2NO2 (g)ӣ
ĻĀĮŠ½įĀŪ²»ÄÜĖµĆ÷ÉĻŹö·“Ó¦ŌŚøĆĢõ¼žĻĀŅŃ¾“ļµ½Ę½ŗāדĢ¬µÄŹĒ £Ø £©
¢ŁN2O4µÄĻūŗÄĖŁĀŹÓėNO2µÄÉś³ÉĖŁĀŹÖ®±ČĪŖ1:2 ¢ŚNO2Éś³ÉĖŁĀŹÓėNO2ĻūŗÄĖŁĀŹĻąµČ ¢ŪÉÕĘæÄŚĘųĢåµÄŃ¹Ēæ²»ŌŁ±ä»Æ ¢ÜÉÕĘæÄŚĘųĢåµÄÖŹĮæ²»ŌŁ±ä»Æ ¢ŻNO2µÄĪļÖŹµÄĮæÅØ¶Č²»ŌŁøÄ±ä ¢ŽÉÕĘæÄŚĘųĢåµÄŃÕÉ«²»ŌŁ¼ÓÉī ¢ßÉÕĘæÄŚĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁ±ä»Æ ¢ąÉÕĘæÄŚĘųĢåµÄĆÜ¶Č²»ŌŁ±ä»Æ”£
A. ¢Ś¢Ū¢Ż¢Ž¢ß B. ¢Ł¢Ü¢ą C. ¢Ü¢Ž¢ß D. Ö»ÓŠ¢Ś¢Ż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æCaCl2ŹĒŅ»ÖÖŅ×ČÜÓŚĖ®µÄĪļÖŹ£¬ĪŽ·ØÓĆ¹żĀĖµÄ·½Ź½½«ĘäŗĶNaCl·ÖĄė£¬¾¹ż·ÖĪöĢÖĀŪ£¬Ä³Š”×éĶ¬Ń§ŌŚ“Ė»ł“”ÉĻ¼ĢŠųÉč¼ĘĮĖČēĶ¼ŹµŃé£ŗ 
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©øĆŠ”×éĶ¬Ń§µÄŹµŃéÄæµÄŹĒ£»
£Ø2£©ÉĻĶ¼ĄØŗÅÄŚµÄ²Ł×÷²½ÖčĪŖ¢Ł¢Ś£»
£Ø3£©°““ĖŹµŃé·½°øµĆµ½µÄNaCl¹ĢĢåÖŠæĻ¶Øŗ¬ÓŠ£ØĢī»ÆѧŹ½£©ŌÓÖŹ£¬ĪŖĮĖ½ā¾öÕāøöĪŹĢāæÉŅŌĻņ¹żĀĖµĆµ½µÄĀĖŅŗÖŠ¼ÓČėŹŹĮæµÄ£ØĢīĆū³Ę£©£®
£Ø4£©ŌŚÄ³Na+ÅضČĪŖ0.3molL©1µÄijĪŽÉ«³ĪĒåČÜŅŗÖŠ£¬»¹æÉÄÜŗ¬ÓŠČōøÉÖÖĄė×Ó£ŗŃōĄė×ÓK+”¢Ag+”¢Ca2+”¢Cu2+£» ŅõĄė×ÓCO32©”¢SO42©”¢Cl©”¢NO3©
ĻÖČ”øĆČÜŅŗ100mL£¬ĻČ¼ÓČė×ćĮæĻ”ĻõĖį£¬·Å³ö±ź×¼×“æöĻĀ0.224LĘųĢ壻ŌŁ¼ÓČė×ćĮæĻ”Ba £ØNO3£©2ČÜŅŗ£¬ÓŠ°×É«³Įµķ²śÉś£¬½«»ģŗĻŅŗ¹żĀĖĻ“µÓøÉŌļµĆ¹ĢĢå2.33g£¬ĀĖŅŗÖŠµĪ¼ÓĻõĖįŅųČÜŅŗĪŽĆ÷ĻŌĻÖĻó£®Ēė»Ų“šĻĀĮŠĪŹĢā£®
¢Ł²»ÄÜČ·¶ØŹĒ·ń“ęŌŚµÄŅõĄė×ÓŹĒ £®
¢ŚÅŠ¶ĻK+ŹĒ·ń“ęŌŚµÄøł¾Ż£»Čō“ęŌŚ£¬c£ØK+£©µÄ×īŠ”ÅضČĪŖmol/L£®
¢Ū»ģŗĻŅŗ¹żĀĖŗóĻ“µÓ³Įµķ£¬¼ģŃé³ĮµķĻ“¾»µÄ·½·ØŹĒ£ŗ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŽÉ«µÄ»ģŗĻĘųĢå¼×ÖŠæÉÄÜŗ¬ÓŠNO”¢CO2”¢NO2”¢NH3”¢N2ÖŠµÄ¼øÖÖ£¬½«100mLĘųĢå¼×¾¹żĶ¼ŹµŃ铦Ąķ£¬½į¹ūµĆµ½ĖįŠŌČÜŅŗ£¬¶ų¼øŗõĪŽĘųĢåŹ£Óą£¬ŌņĘųĢå¼×µÄ×é³ÉæÉÄÜĪŖ£Ø £© 
A.NH3ӢNO2ӢN2
B.NH3”¢NO£¬CO2
C.NH3ӢNO2ӢCO2
D.NO£¬CO2”¢N2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹ŲĖµ·Ø“ķĪóµÄŹĒ( )
A. ¹čæÉÓĆÓŚÖĘŌģ¹āµ¼ĻĖĪ¬ B. Ńõ»ÆĢśæÉ×÷ĶæĮĻŗĶŗģÉ«ÓĶĘį
C. ĀĮČČ·“Ó¦æÉÓĆÓŚŗø½ÓĢś¹ģ D. ³ŹŅŗĢ¬µÄÄĘ¼ŲŗĻ½šæÉÓĆÓŚŌ×Ó·“Ó¦¶ŃµÄČČ½»»»¼Į
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æKClO3¾§ĢåŹĒŅ»ÖÖ³£¼ūµÄŃõ»Æ¼Į£¬Éś²ś¹¤ŅÕČēĶ¼ĖłŹ¾£ŗ
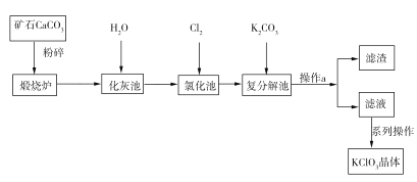
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©CaCO3ģŃÉÕĒ°ŅŖ·ŪĖéµÄÄæµÄŹĒ____________________________”£
£Ø2£©Š“³ö”°ĀČ»Æ³Ų”±ÖŠÉś³ÉCa(ClO3)2µÄ»Æѧ·½³ĢŹ½£ŗ___________________________”£øĆ·“Ó¦ÖŠ£¬Ńõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ________”£
£Ø3£©²Ł×÷aÖŠĖłŠčµÄ²£Į§ŅĒĘ÷ÓŠĀ©¶·”¢ÉÕ±”¢__________”£
£Ø4£©ŹµŃéŹŅÖĘČ”KClO3æÉĶعż·“Ó¦£ŗ3Cl2+6KOH![]() 5KCl+KClO3+3H2O£¬ŌŚĆܱÕČŻĘ÷ÖŠĻņ9 ”ęµÄKOHČÜŅŗÖŠĶØČėÉŁĮæCl2£¬“ĖŹ±Cl2µÄŃõ»Æ²śĪļÖ÷ŅŖŹĒ________________£»¼ĢŠųĶØČėŹŹĮæCl2£¬½«ČÜŅŗ¼ÓČČ£¬ČÜŅŗÖŠÖ÷ŅŖĄė×ÓµÄÅضČĖęĪĀ¶ČµÄ±ä»ÆČēĶ¼ĖłŹ¾£¬Ķ¼ÖŠ¼×”¢ŅŅ”¢±ūŅĄ“Ī±ķŹ¾µÄĄė×ÓŹĒ_________”££Ø²»æ¼ĀĒCl2µÄ»Ó·¢£©
5KCl+KClO3+3H2O£¬ŌŚĆܱÕČŻĘ÷ÖŠĻņ9 ”ęµÄKOHČÜŅŗÖŠĶØČėÉŁĮæCl2£¬“ĖŹ±Cl2µÄŃõ»Æ²śĪļÖ÷ŅŖŹĒ________________£»¼ĢŠųĶØČėŹŹĮæCl2£¬½«ČÜŅŗ¼ÓČČ£¬ČÜŅŗÖŠÖ÷ŅŖĄė×ÓµÄÅضČĖęĪĀ¶ČµÄ±ä»ÆČēĶ¼ĖłŹ¾£¬Ķ¼ÖŠ¼×”¢ŅŅ”¢±ūŅĄ“Ī±ķŹ¾µÄĄė×ÓŹĒ_________”££Ø²»æ¼ĀĒCl2µÄ»Ó·¢£©
£Ø5£©¼×Ķ¬Ń§ĪŖ²ā¶ØÖĘČ”µÄKClO3ѳʷ֊ClO3µÄŗ¬Į棬³ĘȔѳʷa g£¬×¼Č·ÅäÖĘ³É1000 mLČÜŅŗ£¬“ÓÉĻŹöČÜŅŗÖŠČ”³ö10.00 mLӌ׶ŠĪĘæÖŠ£¬×¼Č·¼ÓČė30.00 mL 1.00 mol”¤L1 (NH4)2Fe(SO4)2ČÜŅŗ£Ø¹żĮ棩”£ŌŁŌŚ×¶ŠĪĘæÖŠ¼ÓČė100 mLÕōĮóĖ®¼°Ä³ÖÖŃõ»Æ»¹Ō·“Ó¦ÖøŹ¾¼Į£¬ÓĆ0.200 mol”¤L1 K2Cr2O7±ź×¼ČÜŅŗµĪ¶ØÖĮÖÕµć£¬ĻūŗÄ5.00 mL”£ŃłĘ·ÖŠClO3µÄÖŹĮæ·ÖŹżĪŖ______________”££ØŅŃÖŖ£ŗCr2O72-+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O£¬ClO3æɱ»Fe2+»¹ŌĪŖCl”££©
2Cr3++6Fe3++7H2O£¬ClO3æɱ»Fe2+»¹ŌĪŖCl”££©
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com