
| A. | 苯(硝基苯):加少量水振荡,待分层后分液 | |
| B. | 乙烷(乙烯):光照条件下通入Cl2,气液分离 | |
| C. | 苯(苯酚):加入浓溴水,振荡、静置、过滤 | |
| D. | 乙醇(乙酸):加足量生石灰,蒸馏 |
分析 A.苯和硝基苯都不溶于水;
B.光照条件下,乙烷与氯气发生取代反应;
C.苯酚、三溴苯酚、溴都能溶于苯;
D.乙酸与生石灰反应.
解答 解:A.苯和硝基苯都不溶于水,二者互溶,应该采用蒸馏方法分离,故A错误;
B.光照条件下,乙烷与氯气发生取代反应,应通过溴水除杂,故B错误;
C.Br2和苯酚反应生成2,4,6-三溴苯酚沉淀,但溴单质和2,4,6-三溴苯酚易溶于苯,无法用过滤分开,正确的是加入NaOH反应后分液,故C错误;
D.乙酸与生石灰反应,然后蒸馏可除杂,故D正确.
故选D.
点评 本题考查物质分离、提纯,为高频考点,侧重于学生的分析、实验能力的考查,明确物质的性质是解本题关键,利用物质性质的差异性选取合适的试剂、分离方法进行除杂、分离,难点是除杂剂的选取,不能引进新的杂质还要考虑操作是否简便,易错选项是C.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 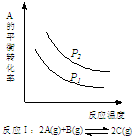 反应:△H>0,P2>P1 | B. | 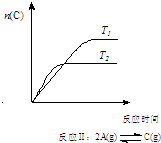 反应:△H<0,T1<T2 | ||
| C. | 反应:△H>0,T2>T1;或△H<0,T2<T1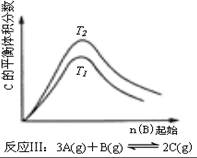 | D. | 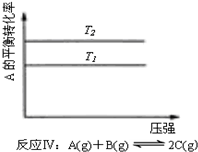 反应:△H<0,T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气有毒,可以毒死细菌、病毒 | |
| B. | 氯气具有刺激性气味,可以熏死细菌、病毒 | |
| C. | 氯气与水反应生成具有强氯化性的HClO,可以杀死细菌、病毒 | |
| D. | 氯气用于自来水消毒没有任何有毒物质残留 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉水解的最终产物是葡萄糖 | |
| B. | 植物油不能使溴的四氯化碳溶液褪色 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
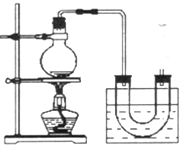 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
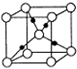 已知A、B、C、D、E、F、G、H均为前四周期元素且原子序数依次增大,A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;元素C的基态原子2p轨道有3个未成对电子,元素D的原子最外层电子数是其内层电子数的3倍,元素F的一种常见单质为淡黄色粉末,G的内层轨道全部排满电子,且最外层电子数为1.E是地壳中含量最高的金属元素;H与E同主族.
已知A、B、C、D、E、F、G、H均为前四周期元素且原子序数依次增大,A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;元素C的基态原子2p轨道有3个未成对电子,元素D的原子最外层电子数是其内层电子数的3倍,元素F的一种常见单质为淡黄色粉末,G的内层轨道全部排满电子,且最外层电子数为1.E是地壳中含量最高的金属元素;H与E同主族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH3 | B. | CH3CH2OH | C. | CH3CHO | D. | CH3COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com