
 室温时,向20mL 0.1mol?L-1NH4HSO4溶液中滴加0.1mol?L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气
室温时,向20mL 0.1mol?L-1NH4HSO4溶液中滴加0.1mol?L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气| A、PH=7时,溶液中c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B、当V(NaOH)=20mL时,溶液中水的电离程度比纯水大 |
| C、当V(NaOH)=30mL时,溶液中 c(SO42-)+c(H+)=c(NH3?H2O)+c(OH-) |
| D、滴加NaOH溶液从30mL至40mL,溶液中Na+与SO42-浓度之和始终为0.1 mol?L-1 |
| 0.1×20+0.1×x |
| 20+x |
| 0.1×20+0.1×x |
| 20+x |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
| A、氟化氢水溶液中存在的氢键有4种 |
| B、H-O键键能为463 kJ?mol-1,即18 g 气态水分解成H2和O2时,消耗能量为2×463 kJ |
| C、将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液,观察现象可比较26Al、26Mg金属性强弱 |
| D、室温下,V1 L pH=3的硫酸与V2LpH=11的NaOH溶液溶液混合,忽略分子间间隙引起的体积变化,若混合后溶液pH=4,则V1:V2=11:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,相对分子质量为116的芳香烃A有如图的转化关系:
,相对分子质量为116的芳香烃A有如图的转化关系: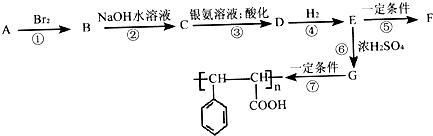
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、R原子最外层电子数为5 |
| B、单质的氧化性:甲>乙 |
| C、原子半径:R>Z |
| D、HRO3与HZ的计量数比为5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
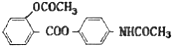 ,其合成途径如下:
,其合成途径如下: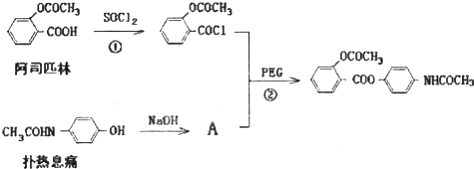 完成下列填空:
完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:

| NaOH/H2O |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 高铁酸盐在能源环保领域有广泛用途.用镍(Ni),铁做电极电解浓氢氧化钠溶液制备Na2FeO4的装置如图,说法合理的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni),铁做电极电解浓氢氧化钠溶液制备Na2FeO4的装置如图,说法合理的是( )| A、镍是阳极,电极反应4OH--4e-=2H2O+O2↑ |
| B、电解时电流方向:负极→镍电极→溶液→铁电极→正极 |
| C、若隔膜是阴离子交换膜,则OH-自右向左移动 |
| D、电解时阳极区pH降低,阴极区pH升高,撤去隔膜后与原溶液比较pH降低(假设电解前后体积变化忽略不计) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com