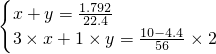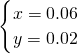解:最后溶液中尚余4.4g固体,该固体是铁,则溶液中铁以亚铁离子存在,即溶液中的溶质是硝酸亚铁,
(1)反应至结束共收集到气体1792mL气体(均为标况下测定,不考虑N
2O
4存在),混合气体的物质的量=

=
0.08mol,反应消耗铁的物质的量=
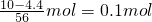
,无论是二氧化氮还是一氧化氮,n(NO
x)=n(HNO
3)(作氧化剂),n[Fe(NO
3)
2]=

n(HNO
3)(作酸),根据氮原子守恒,硝酸的物质的量=n(NO
x)+2n[Fe(NO
3)
2]=0.08mol+0.1mol×2
=0.28mol,C(HNO
3)=
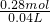
=7 mol/L,答:原硝酸的物质的量浓度是7 mol/L;
(2)设n(NO)是xmol,n(NO
2)是ymol,结合转移电子守恒列方程组为:
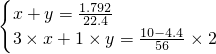
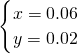
答:混合气体中一氧化氮和二氧化氮的物质的量分别是 0.06mol、0.02mol;
(3)该反应中,铁先和浓硝酸反应生成硝酸铁和二氧化氮、水,当硝酸降低到一定程度后,硝酸和铁反应生成硝酸铁、一氧化氮和水,当硝酸完全反应后,铁再和硝酸铁反应生成硝酸亚铁,
铁的物质的量是0.1mol,参加反应的硝酸的物质的量是0.28mol,生成一氧化氮的物质的量是0.06mol,二氧化氮的物质的量是0.02mol,则这几种物质之间的计量数之比是0.1mol:0.28mol:0.06mol:0.02mol=5:14:3:1,
所以其方程式为:5Fe+14HNO
3=5Fe(NO
3)
2+3NO↑+NO
2↑+7H
2O,
答:该反应过程中的总化学方程式是5Fe+14HNO
3=5Fe(NO
3)
2+3NO↑+NO
2↑+7H
2O.
分析:最后溶液中尚余4.4g固体,该固体是铁,则溶液中铁以亚铁离子存在,即溶液中的溶质是硝酸亚铁,
(1)根据氮原子守恒计算硝酸的物质的量浓度;
(2)根据氮原子守恒及得失电子数相等列方程组解出一氧化氮和二氧化氮的物质的量;
(3)该反应中,铁先和浓硝酸反应生成硝酸铁和二氧化氮、水,当硝酸降低到一定程度后,硝酸和铁反应生成硝酸铁、一氧化氮和水,当硝酸完全反应后,铁再和硝酸铁反应生成硝酸亚铁,根据铁、硝酸、一氧化氮和二氧化氮的物质的量之比确定其计量数之比,从而得出该反应方程式.
点评:本题考查了氧化还原反应的计算,明确铁和硝酸反应过程中发生的反应是解本题的关键,注意铁先和硝酸反应生成硝酸铁,然后铁再和硝酸铁反应生成硝酸亚铁,再结合原子守恒、得失电子守恒来分析解答即可,难度较大.

 =
=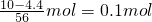 ,无论是二氧化氮还是一氧化氮,n(NOx)=n(HNO3)(作氧化剂),n[Fe(NO3)2]=
,无论是二氧化氮还是一氧化氮,n(NOx)=n(HNO3)(作氧化剂),n[Fe(NO3)2]= n(HNO3)(作酸),根据氮原子守恒,硝酸的物质的量=n(NOx)+2n[Fe(NO3)2]=0.08mol+0.1mol×2
n(HNO3)(作酸),根据氮原子守恒,硝酸的物质的量=n(NOx)+2n[Fe(NO3)2]=0.08mol+0.1mol×2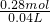 =7 mol/L,答:原硝酸的物质的量浓度是7 mol/L;
=7 mol/L,答:原硝酸的物质的量浓度是7 mol/L;