
分析 (1)摩尔质量以g/mol为单位,数值上等于其相对分子质量;
(2)依据Vm=$\frac{M}{ρ}$计算解答;
(3)依据摩尔质量和阿伏加德罗常数NA=6.02×1023mol-1解答;
(4)依据V0=$\frac{V}{N{\;}_{A}}$计算解答;
(5)将乙醇分子看做是个球体,依据V0=$\frac{πd{\;}^{3}}{6}$计算.
解答 解:(1)摩尔质量以g/mol为单位,数值上等于其相对分子质量,乙醇(俗称酒精)的相对分子质量是46,所以其摩尔质量为:46g/mol,或者4.6×10-2Kg/mol;
故答案为:46;4.6×10-2;
(2)乙醇的摩尔体积V=$\frac{M}{ρ}$=$\frac{4.6×1{0}^{-2}kg/mol}{7.9×102kg/{m}^{3}}$=5.8×10-5m3/mol;
故答案为:5.8×10-5;
(3)乙醇摩尔质量为46g/mol,阿伏加德罗常数NA=6.02×1023mol-1,则一个乙醇分子的质量m0=$\frac{46}{6.02×1{0}^{23}}$=7.64×10-23g,7.64×10-26Kg
故答案为:7.64×10-26;
(4)一个乙醇分子的体积V0=$\frac{V}{N{\;}_{A}}$=$\frac{5.8×1{0}^{-5}}{6.02×1{0}^{23}}$m3=9.6×10-29m3;
故答案为:9.6×10-29;
(5)将乙醇分子看做是个球体,依据V0=$\frac{πd{\;}^{3}}{6}$,则d=$\root{3}{\frac{6V{\;}_{0}}{π}}$m≈5.7×10-10m;
故答案为:5.7×10-10.
点评 本题考查了有关物质的量计算,熟悉以物质的量为核心计算公式是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大气中的SO2、NO2是酸性氧化物,与酸雨的形成密切相关 | |
| B. | 氢氧化铝常用于治疗胃酸过多,过量服用会造成重金属中毒 | |
| C. | 制豆腐时向豆浆中加入硫酸钙使蛋白质等聚沉,可制成豆腐 | |
| D. | 氢氧燃料电池是一种高能电池,释放的电能与等量氢气完全燃烧释放的热能相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 可能与某类物质反应 | 具体的离子反应方程式 | |
| CuCl2 | 金属单质 | ①Cu2++Fe=Cu+Fe2+ |
| ②氢氧化钠 | ③Cu2++2OH-=Cu(OH)2↓ | |
| ④硝酸银 | Ag++Cl-═AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
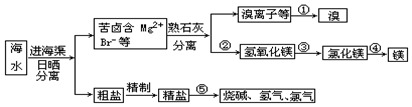
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24LC2H4和C2H2的混合气体中含碳原子数目小于0.2NA | |
| B. | 100mL1.0mol/L的FeCl3溶液与足量Cu反应,转移电子数数为0.2NA | |
| C. | 标况下44.8mL氯气通入足量水中发生反应,转移电子数为2×10-3NA | |
| D. | 常温下,pH=2的H2SO4溶液中含有的H+数目为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
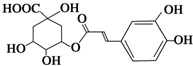 从金银花中提取的绿原酸结构简式如图所示.其有抗菌、消炎、解毒.利胆.降压和增加胃肠蠕动的作用.用于急性细菌性感染及放、化疗所致的白细胞减少症.下列说法不正确的是( )
从金银花中提取的绿原酸结构简式如图所示.其有抗菌、消炎、解毒.利胆.降压和增加胃肠蠕动的作用.用于急性细菌性感染及放、化疗所致的白细胞减少症.下列说法不正确的是( )| A. | 绿原酸的分子式为C16H18O9 | |
| B. | 绿原酸及其水解产物之一在空气中均能稳定存在,遇FeCl3溶液时显紫色 | |
| C. | 1mol绿原酸与NaOH溶液反应时,最多消4molNaOH | |
| D. | 1mol绿原酸与足量金属Na反应时能产生3molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c (NH3•H2O)>c (NH4+)>c (H+)>c (OH-) | B. | c (NH4+)>c (NH3•H2O)>c (OH-)>c (H+) | ||
| C. | c (NH3•H2O)>c (NH4+)=c (OH-)>c (H+) | D. | c (NH3•H2O)>c (OH-)>c (NH4+)>c (H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com