
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应为:2Cl--2e- Cl2↑
Cl2↑
B.氢氧燃料电池的负极反应:O2+2H2O+4e- 4OH-
4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应为:Cu-2e- Cu2+
Cu2+
D.钢铁发生电化学腐蚀的正极反应:Fe-2e- Fe2+
Fe2+
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是( )
①1∶3 ②2∶3 ③1∶7 ④2∶7 ⑤任意比
A.⑤ B.只有① C.② ④ D.① ③
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时(人教选修4)4.4金属的电化学腐蚀与防护(解析版) 题型:选择题
下列叙述中正确的是( )
①锌跟稀硫酸反应制H2,加入少量硫酸铜溶液能加快反应速率;
②镀层破损后,白口铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀;
③电镀时,应把镀件置于电解槽的阴极;
④冶炼铝时,把氧化铝加入液态冰晶石中熔融后电解;
⑤钢铁表面常易锈蚀生成Fe2O3·nH2O。
A.①②③④⑤B.①③④⑤ C.①③⑤ D.②④
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时(人教选修4)2.2影响化学反应速率的因素(解析版) 题型:选择题
下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是( )
A.Cu能与浓硝酸反应,而不与浓盐酸反应
B.Cu与浓硝酸反应比与稀硝酸反应快
C.N2与O2在常温、常压下不反应,放电时可反应
D.Cu与浓硫酸反应,而不与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第四章检测试卷(解析版) 题型:选择题
500 mL KNO3和Cu(NO3)2的混合溶液中c(N)= 6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为2 mol·L-1
B.上述电解过程中共转移2 mol电子
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第二章检测试卷(解析版) 题型:填空题
氨是最重要的氮肥,是产量最大的化工产品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)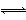 2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。
2NH3(g) ΔH=-92.4 kJ·mol-1,他因此获得了1918年诺贝尔化学奖。
在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:
N2(g)+3H2(g)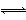 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是 ;N2和H2的转化率比是 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,密度 。(填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第二章检测试卷(解析版) 题型:选择题
反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.8 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为( )
2SO3经一段时间后,SO3的浓度增加了0.8 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为( )
A.0.1 sB.2.5 sC.5 sD.10 s
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第一章检测试卷(解析版) 题型:选择题
已知:2Zn(s)+O2(g) 2ZnO(s) ΔH=-701.0 kJ·mol-1
2ZnO(s) ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g) 2HgO(s) ΔH=-181.6 kJ·mol-1
2HgO(s) ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s) ZnO(s)+Hg(l)的ΔH为( )
ZnO(s)+Hg(l)的ΔH为( )
A.+519.4 kJ·mol-1B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1D.-519.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.2.2燃料电池试卷(解析版) 题型:选择题
据报道,摩托罗拉公司研制了一种有甲醇和氧气,以及强碱作电解质的手机电池,电量可达到镍氢电池的10倍,有关此电池的叙述错误的是( )
A.溶液中的阳离子移向正极
B.负极反应式:CH3OH+8OH--6e- C+6H2O
C+6H2O
C.电池在使用过程中,电解质溶液的c(OH-)不变
D.当外电路通过6 mol电子时,理论上消耗1.5 mol O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com