
| A. | 原子序数之差为2的两种元素不可能位于同一主族 | |
| B. | D-核外有36个电子,则元素D位于第四周期第ⅦA族 | |
| C. | 位于同一主族的甲乙两种元素,甲的原子序数为x,则乙的原子序数可能为x+4 | |
| D. | 位于同一周期的甲乙两种元素,甲位于第ⅠA族,原子序数为x,乙位于第ⅢA族,则乙原子序数可能为x+19 |
分析 A、氢和锂两种元素原子序数之差为2是同一主族;
B、D-核外有36个电子,则D原子有25个电子,为Br元素;
C、同主族相邻两周期原子序数差值可能为2、8、18、32等;
D、第二周期,IIA族4号的Be---IIIA族元素5号的B,y可能等于x+1;第三周期,IIA族与IIIA族元素也相差1(因为没有副族元素);第四、五周期,IIA族与IIIA族元素相差11,y可能等于x+11 (因为出现副族元素)例如:20元素钙与31号元素镓;第六周期,IIA族与IIIA族元素相差25,y可能等于x+25 (因为出现镧系元素)例如:56号元素Ba与81号元素Tl.
解答 解:A、氢和锂两种元素原子序数之差为2是同一主族,原子序数之差为2的两种元素可能位于同一主族,故A错误;
B、D-核外有36个电子,则D原子有25个电子,为Br元素,Br位于第四周期第VIIA族,故B正确;
C、同主族相邻两周期原子序数差值可能为2、8、18、32等,所以同一主族的甲乙两种元素,甲的原子序数为x,则乙的原子序数不可能为x+4,故C错误;
D、第二周期,IIA族4号的Be---IIIA族元素5号的B,y可能等于x+1;第三周期,IIA族与IIIA族元素也相差1(因为没有副族元素);第四、五周期,IIA族与IIIA族元素相差11,y可能等于x+11 (因为出现副族元素)例如:20元素钙与31号元素镓;第六周期,IIA族与IIIA族元素相差25,y可能等于x+25 (因为出现镧系元素)例如:56号元素Ba与81号元素Tl,所以不可能为:x+19,故D错误;
故选B.
点评 本题考查同周期元素的原子序数的关系,为高频考点,明确元素周期表的结构及族的位置是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色 | |
| B. | 向盛有20g蔗糖的烧杯中加入几滴水,搅拌均匀:再加入少许浓硫酸,迅速搅拌,探究浓硫酸的吸水性 | |
| C. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| D. | 将表面有铜绿[Cu2(OH)2C03]的铜器放入盐酸中浸泡,除去铜绿 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.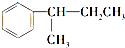 $\stackrel{酸性KMnO_{4}溶液}{→}$
$\stackrel{酸性KMnO_{4}溶液}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L N2和 H2 混合气中含 NA个原子 | |
| B. | 3 mol 单质 Fe 完全转变为 Fe3O4,失去 8NA个电子 | |
| C. | 2 L 0.5 mol•L-1硫酸钾溶液中,含有 NA个阳离子 | |
| D. | 标准状况下,2128 mL 甲醛含有 2.85NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成原电池正极和负极的不一定是两种不同的金属 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 在原电池中,电子流出的一极是负极,发生氧化反应 | |
| D. | 原电池放电时,电流的方向是从负极到正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(K) CO2转化率(%) $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com