
| A. | 0.1mol/L CH3COONa溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | Na2CO3溶液加水稀释后,恢复至原温度,pH增大和KW不变 | |
| C. | 一定温度下,pH=6的HCl溶液和pH=6的NH4Cl溶液中,c(H+)相等 | |
| D. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)不变化 |
分析 A.CH3COONa溶液显碱性;
B.溶液稀释浓度减小,pH减小;
C.一定温度下,根据c(H+)=10-pH计算;
D.溶解度小的沉淀能转化为溶解度更小的.
解答 解:A.CH3COONa溶液显碱性,则0.1mol/L CH3COONa溶液:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故A错误;
B.Na2CO3溶液显碱性,加水稀释后溶液浓度减小,pH减小,Kw不变,故B错误;
C.一定温度下,c(H+)=10-pH,则pH=6的HCl溶液和pH=6的NH4Cl溶液中,c(H+)相等为10-6mol/L,故C正确;
D.溶解度小的沉淀能转化为溶解度更小的,所以在Na2S溶液中加入AgCl固体,会生成Ag2S沉淀,则溶液中c(S2-)减小,故D错误.
故选C.
点评 本题考查了盐类水解、Kw、沉淀的转化等,注意把握盐类水解的规律和溶液酸碱性的判断,为解答该题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
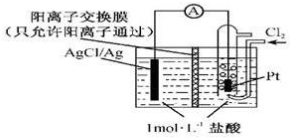
| A. | 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 正极反应为Ag-e-=Ag+ | |
| D. | 用KCl溶液代替盐酸,则电池总反应随之改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯易溶于水 | |
| B. | 苯分子中含有碳碳双键和碳碳单键 | |
| C. | 苯能使溴水和酸性高锰酸钾溶液褪色 | |
| D. | 苯在一定条件下能发生取代反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 常温常压下,78g苯中含有碳碳双键的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
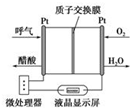 酒后驾车已成为一个社会问题.2013年1月1日起执行的新交通法规对酒后驾车作出严厉的处罚规定,检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.
酒后驾车已成为一个社会问题.2013年1月1日起执行的新交通法规对酒后驾车作出严厉的处罚规定,检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑥ | C. | ②③⑥ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
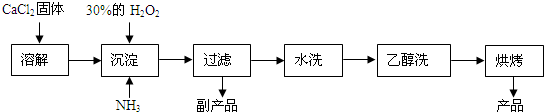
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液 | B. | AgNO3溶液 | C. | HCl溶液 | D. | 稀Na2SO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com