
【题目】工业上用铝土矿(主要成分是氧化铝,含氧化铁杂质)为原料冶炼铝的工艺流程如下:
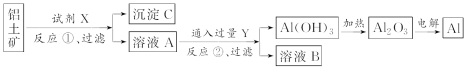
下列叙述正确的是( )
A. 反应①中试剂X是氢氧化钠溶液
B. 试剂Y是HCl,它与AlO![]() 反应生成氢氧化铝
反应生成氢氧化铝
C. 图中所示转化反应中包含2个氧化还原反应
D. 将X与Y试剂进行对换,最终可以达到相同结果
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣(有效成分为Fe2O3 和Fe3O4)制备PFS,其工艺流程如下图所示。

(1)还原焙烧过程中,CO还原Fe3O4生成FeO的热化学方程式为________________________。
已知: Fe3O4(s)+C(s)= 3FeO(s)+CO(g) ΔH1=+191.9kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
C(s)+CO2(g)=2CO(g) ΔH3=+172.5kJ·mol-1
(2)CO是还原焙烧过程的主要还原剂。下图中,曲线表示4个化学反应a、b、c、d达到平衡时气相组成和温度的关系,I、Ⅱ、Ⅲ、Ⅳ分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域。a属于_________(填“吸热反应”或“放热反应”);570℃时,d反应的平衡常数K= ____________。

(3)工业上,还原焙烧的温度一般控制在800℃左右,温度不宜过高的理由是___________________。
(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是___________________________。
(5)FeSO4溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,该反应的离子方程式为_____________________________。“催化氧化”过程用NaNO2作催化剂(NO起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+转化率随温度的升高先上升后下降的原因是___________________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在医药生产中有许多重要用途。请回答下列问题:
(1)砷与同周期第ⅦA族的溴的第一电离能相比,较大的是_______________________。
(2)气态氢化物稳定性:NH3 ______________ AsH3,其主要原因是___________________。
(3)①肼(N2H4)分子可视为NH3分子中的一个氢原子被NH2(氨基)取代形成的另一种氮的氢化物。则N2H4电子式为_______________。
②工业上将NH3或(CH3)2CO与氯气反应后水解制取N2H4,(CH3)2CO中碳原子轨道的杂化类型为_______________,1 mol(CH3)2 CO中的π键数目为___________。
③N2H4分子中存在的共价键类型有________(填选项字母)。
A.非极性键 B.极性键 C.s-s σ键 D.s-p σ键
E.p-p π键 F.s-sp3 σ键 G.sp3-sp3 σ键 H.sp3-sp3 π键
(4)已知N2H5+与N2H62+是由中性分子结合质子形成的,有类似于 NH4+的性质。
①写出N2H62+在碱性溶液中反应的离子方程式:_________________________________。
②据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是____________。
(5)Na3AsO4可作杀虫剂。AsO![]() 的空间构型为__________,与其互为等电子体的一种分子为________。
的空间构型为__________,与其互为等电子体的一种分子为________。
(6)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为__________,砷原子采取___________杂化。
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:_____H2O2 +___Cr2(SO4)3 +_______KOH=________K2CrO4 +________K2SO4 +_______H2O
(1)配平该方程式,并用单线桥法表示电子转移情况。
(2)此反应中氧化剂是__________。
(3)若消耗1molL-1Cr2(SO4)3溶液的体积为50mL,则转移电子的物质的量是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从1L1 mol/L的NaOH溶液中,取出50mL溶液,该50mL NaOH溶液的物质的量浓度为
A.0.02mol/L B.0.2mol/L C.1 mol/L D.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与反应的分类正确的是
A.纯碱、醋酸钠分别属于碱和盐
B.Na、Na2O2与水的反应均是置换反应
C.氯水和次氯酸都属于弱电解质
D.铝与强酸、强碱的反应都属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2→4LiCl+S+SO2,下列有关判断正确的是(提示:SOCl2中S显![]() 价)
价)
A. 还原剂只有Li
B. SOCl2既是氧化剂又是还原剂
C. 还原产物包括LiCl和S
D. 生成1.12LSO2时,反应转移电子为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为:
C. NCl3分子是非极性分子
D. NBr3比NCl3易挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
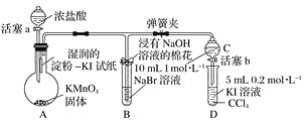
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是________________________________________。
(2)B中溶液发生反应的离子方程式是____________________________________________。
(3)为验证溴的氧化性强于碘,过程 Ⅳ 的操作和现象是____________________________。
(4)过程Ⅲ实验的目的是________________________________________________________。
(5)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,原子半径逐渐________,得电子能力逐渐________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com