
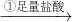
 溶液
溶液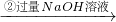 过滤,得到沉淀质量为5.8g
过滤,得到沉淀质量为5.8g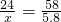 ,解得x=2.4g,所以金属镁的质量分数=
,解得x=2.4g,所以金属镁的质量分数=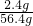 ×100%=4.26%,
×100%=4.26%,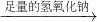 溶液
溶液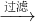 固体难溶物,称量得到固体质量即为金属镁的质量,进而计算金属镁的质量分数,
固体难溶物,称量得到固体质量即为金属镁的质量,进而计算金属镁的质量分数,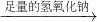 溶液
溶液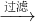 固体难溶物,称量得到固体质量.
固体难溶物,称量得到固体质量.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
| ①足量盐酸 |
| ②过量NaOH溶液 |
| 过滤 |
| 足量的NaOH溶液 |
| 足量盐酸 |
| 24m1 |
| 58m2 |
| 24m1 |
| 58m2 |
| 9V1 |
| 11.2m1 |
| 9V1 |
| 11.2m1 |
| 44.8m1-36V2 |
| 11.2m1 |
| 44.8m1-36V2 |
| 11.2m1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
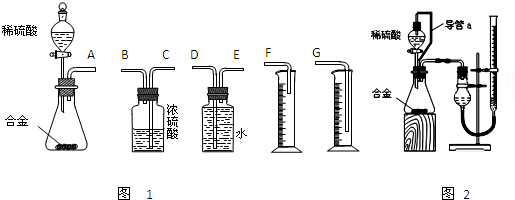
[探究一]
实验方案:铝镁合金![]() 测定剩余固体质量
测定剩余固体质量
实验中发生反应的化学方程式是______________________。
实验步骤:(1)称取
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将_________(填“偏高”或“偏低”)。
[探究二]
实验方案:铝镁合金![]() 测定生成气体的体积
测定生成气体的体积
实验装置:

问题讨论:(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是_____________。(填“需要”或“不需要”)
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
①_______________________________,②________________________________。
[探究三]
实验方案:称量x g铝镁合金粉末,放在如下图所示装置的惰性电热板上,通电使其充分灼烧。

问题讨论:(1)欲计算Mg的质量分数,该实验中还需测定的数据是____________。
(2)若用空气代替O2进行实验,对测定结果是否有影响?___________(填“是”或“否”)。
[实验拓展]
参照探究一、探究二的实验方案,请你另设计一个实验方案,测定该铝镁合金中镁的质量分数。
____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溶液
溶液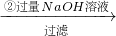 得到沉淀的质量为m2g;
得到沉淀的质量为m2g;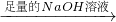 生成的气体在标准状况下的体积为V1L.
生成的气体在标准状况下的体积为V1L. 生成的气体在标准状况下的体积为V2L.
生成的气体在标准状况下的体积为V2L.查看答案和解析>>
科目:高中化学 来源:2009-2010学年山东省德州市高一(上)期末化学试卷(解析版) 题型:解答题
 溶液
溶液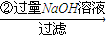 得到沉淀的质量为m2g;
得到沉淀的质量为m2g;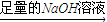 生成的气体在标准状况下的体积为V1L.
生成的气体在标准状况下的体积为V1L. 生成的气体在标准状况下的体积为V2L.
生成的气体在标准状况下的体积为V2L.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com