
分析 (1)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,生成的氢气为可燃气体,遇到明火易发生爆炸;根据“易拉罐主要成分为铝,另含有镁、铁等”分析滤渣的主要成分;
(2)若溶液pH过低,氢氧化铝会与氢离子反应生成铝离子;将氢氧化铝沉淀放入过滤装置中反复用水冲洗;
(3)溶解氢氧化铝和硫酸钾固体的过程中需要用玻璃棒搅拌;硫酸铝、硫酸钾和水反应生成KAl(SO4)2•12H2O,据此写出反应的方程式;
(4)明矾能够溶于水,不溶于无水酒精,据此进行判断;
(5)检验SO42-,可先加入盐酸,无现象,再加入氯化钡溶液观察是否有沉淀生成;
(6)根据n=$\frac{m}{M}$计算出明矾的物质的量,再根据质量守恒定律计算出需要铝的质量,最后计算出铝片中铝元素的最低百分含量.
解答 解:(1)骤2中铝片溶于烧碱的反应建议在通风橱中进行,用热水浴加热,避免明火,原因是铝与氢氧化钠溶液反应生成可燃性气体氢气,若用灭火容易发生爆炸现象;
易拉罐主要成分为铝,另含有镁、铁等,镁、铁等杂志不与氢氧化钠溶液反应,所以滤渣的主要成分为镁、铁等,
故答案为:反应中生成的氢气遇到明火易爆炸;镁、铁等;
(2)氢氧化铝为两性氢氧化物,步骤3中若调节pH过低,会导致部分氢氧化铝溶解;洗涤氢氧化铝沉淀的方法是:用布氏漏斗抽滤,并用热水洗涤沉淀,
故答案为:部分氢氧化铝溶解;用布氏漏斗抽滤,并用热水洗涤沉淀;
(3)过滤后所得氢氧化铝沉淀转入蒸发皿中,加10mL 9mol/L H2SO4,再加15mL水,小火加热使其溶解,加入4g硫酸钾继续加热至溶解,在溶解的过程中都需要使用玻璃棒,所以还缺少的仪器为玻璃棒;加入硫酸钾后制取明矾的化学反应方程式为:Al2(SO4)3+K2SO4+24H2O=2KAl(SO4)2•12H2O,
故答案为:Al2(SO4)3+K2SO4+24H2O=2KAl(SO4)2•12H2O;
(4)由于明矾溶于水、不溶于无水酒精,所以用无水酒精洗涤明矾晶体而不能使用水洗涤;
故答案为:明矾易溶于水、不溶于无水酒精;
(5)检验SO42-的方法为:取少量明矾溶于水,先加入盐酸,无现象,再加入氯化钡溶液生成白色沉淀,证明明矾中存在硫酸根离子,
故答案为:取少量明矾溶于水,先加入盐酸,无现象,再加入氯化钡溶液生成白色沉淀,证明明矾中存在硫酸根离子;
(6)该实验制得明矾15.8g,明矾的物质的量为:$\frac{15.8g}{474g/mol}$=$\frac{1}{30}$mol,根据质量守恒,制备15.8g明矾需要金属铝的质量为:27g/mol×$\frac{1}{30}$mol=0.9g,
由于制备过程中会有损失的铝元素,则称取的1g铝片中铝元素含量不低于:$\frac{0.9g}{1g}$×100%=90%,
故答案为:90.
点评 本题考查了物质制备方案的设计、化学实验基本操作方法及其综合应用,题目难度中等,明确制备原理为解答根据,注意掌握化学实验基本操作方法,试题充分考查了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题

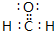 ,推测该分子的空间构型为平面三角形.
,推测该分子的空间构型为平面三角形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是烃类化合物 | B. | 常温下呈固态 | ||
| C. | 具有类似金刚石的硬度 | D. | 分子中最多可能有281个碳碳叁键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D是中学化学中常见的四种不同微粒.它们之间存在如图中转化关系:
已知A、B、C、D是中学化学中常见的四种不同微粒.它们之间存在如图中转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在烧瓶中将熟石灰和氯化铵混合,加水调成泥糊状后加热 | |
| B. | 将烧瓶中的浓氨水加热 | |
| C. | 加热试管中的氯化铵固体 | |
| D. | 将分液漏斗中的浓氨水滴入装有浓硫酸的烧瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯中含有S02杂质,可将混合气体通入酸性KMn04溶液以提纯 | |
| B. | 向淀粉溶液中加入少盘稀硫酸,加热4〜5min,待溶液冷却后加入含氢氧化钠的氢氧化铜悬浊液,加热至沸腾,若未见砖红色沉淀生成,说明淀粉未水解 | |
| C. | 通过钠、镁分别与冷水反应的剧烈程度,可以比较钠、镁的金属性强弱 | |
| D. | 向溴水中加入乙醇,充分振荡,可以将溴水中的Br2萃取出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
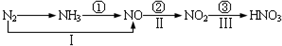
| A. | 路线①②③是工业生产硝酸的主要途径 | |
| B. | 路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径 | |
| C. | 上述所有反应都是氧化还原反应 | |
| D. | 上述反应中①②③均属于氮的固定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com