
| A. | -332 | B. | -118 | C. | 350 | D. | 130 |
分析 由①C(s)+H2O(g)═CO(g)+H2(g)△H=a kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1,
结合盖斯定律可知,①×②-②得到2H2O(g)═2H2(g)+O2(g)△H=(2a+220)kJ/mol,结合焓变等于反应物中键能之和减去生成物中键能之和,以此来解答.
解答 解:由①C(s)+H2O(g)═CO(g)+H2(g)△H=a kJ•mol-1
②2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1,
结合盖斯定律可知,①×②-②得到2H2O(g)═2H2(g)+O2(g)△H=(2a+220)kJ/mol,
H-H、O═O和O-H的键能分别为436kJ•mol-1、496kJ•mol-1和462kJ•mol-1,
则462×2×2-436×2-496=2a+220,
解得a=130,
故选D.
点评 本题考查反应热与焓变,为高频考点,把握盖斯定律的应用、焓变与键能的关系为解答的关键,侧重分析与应用能力的考查,注意C与水蒸气的反应为吸热反应,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 加入乙醇的目的是降低溶剂的极性,促使[Cu(NH3)4]SO4晶体析出 | |
| B. | 该配合物晶体中,N是配位原子,NH3为三角锥形,配位数是4 | |
| C. | 配离子内N原子排列成为平面正方形,可见Cu2+是sp3杂化 | |
| D. | 向该晶体的水溶液中加入浓BaCl2溶液无白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
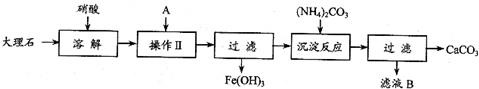
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①表示2molC(s)燃烧生成2molCO(g)需要吸收221 kJ的热量 | |
| B. | 碳的燃烧热大于110.5 kJ/mol | |
| C. | 稀硫酸与浓NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
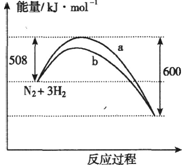
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92kJ•mol-1 | |
| B. | a曲线是加入催化剂时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的反应热改变 | |
| D. | 在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为69kJ,则N2的转化率为75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
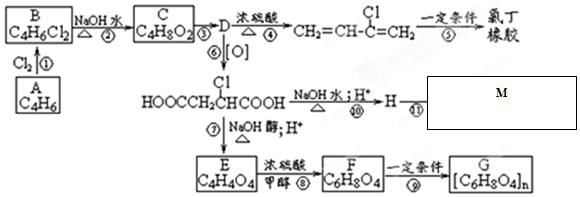

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验用品 | 溶液温度 | 中和热 | |||
| t1 | t2 | △H | |||
| ① | 50 mL 0.55 mol•L-1 NaOH溶液 | 50 mL 0.5 mol•L-1 HCl溶液 | 20℃ | 23.3℃ | -56.8kJ/mol |
| ② | 50 mL 0.55 mol•L-1 NaOH溶液 | 50 mL 0.5 mol•L-1 HCl溶液 | 20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓HNO3能与碳反应,说明其具有强氧化性 | |
| B. | 浓HNO3能溶解金属铜,说明其具有强酸性 | |
| C. | 浓HNO3不稳定易分解,需要避光保存 | |
| D. | 常温下浓HNO3能使金属铝钝化,可以用铝槽车运输浓HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com