
| A. | 用pH试纸测定Na2CO3溶液的pH | |
| B. | 从食盐水中提取NaCl | |
| C. | 用新制的FeSO4溶液和NaOH溶液制备Fe(OH)2 | |
| D. | 配制100ml 0.1000mol/L的NaCl溶液 |
分析 A.用pH试纸测定Na2CO3溶液的pH,可用玻璃棒蘸取溶液;
B.从食盐水中提取NaCl,用到过滤和蒸发操作;
C.无需使用玻璃棒;
D.配制一定物质的量浓度的溶液用玻璃棒搅拌和引流.
解答 解:A.用pH试纸溶液的pH,可用玻璃棒蘸取溶液,滴在玻璃片上的pH试纸上观察,故A正确;
B.从食盐水中提取NaCl,用到过滤和蒸发操作,分别用玻璃棒进行引流和搅拌,故B正确;
C.用新制的FeSO4溶液和NaOH溶液制备Fe(OH)2不需要使用玻璃棒,故C错误;
D.配制一定物质的量浓度的氯化钠溶液用玻璃棒搅拌和引流,故D正确.
故选C.
点评 本题考查化学实验基本操作,题目难度不大,注意常见化学基本操作以及实验的注意事项.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
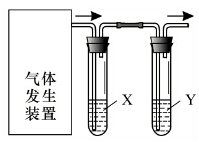 实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( ) | 选项 | 实验目的 | 试剂X | 试剂Y |
| A | 验证C2H5OH与浓H2SO4加热至170℃制得的乙烯的性质 | NaOH溶液 | Br2水 |
| B | 检验FeSO4受热分解产生的气体中由SO3和SO2 | BaCl2溶液 | 品红溶液 |
| C | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
| D | 验证氧化性:Cl2>Br2>I2 | NaBr溶液 | KI溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度 (mol•L-1) | NaOH物质的量浓度 (mol•L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | C1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O | |
| B. | 2HCl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| C. | HCl+AgNO3═AgCl↓+HNO3 | |
| D. | Zn+2HCl═ZnCl2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3 kJ•molˉ1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•molˉ1 | |
| B. | 由C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•molˉ1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OHˉ(aq)=H2O(l)△H=-57.3 kJ•molˉ1,若将含1 mol CH3COOH与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ | |
| D. | 一定条件下,某密闭容器中充入2 mol SO2(g)和1 mol O2(g),达到平衡后,放出Q kJ热量,则该条件下的热化学方程式为:2SO2(g)+O2(g)?2SO3(g )△H=-Q kJ•molˉ1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com