

| 序号 | 平衡移动的因素(填序号) | 平衡移动的方向(填序号) |
| A | ||
| B | ||
| C | ||
| D |
分析 已知可逆反应2A(g)?B(g)△H<0,该反应正方向为放热的、体积减小的反应,根据温度及压强对平衡的影响分析.
解答 解:已知可逆反应2A(g)?B(g)△H<0,该反应正方向为放热的、体积减小的反应;
A、图象A中改变条件后,反应物A的浓度增大,生成物B的浓度减小,则平衡逆向移动,AB的浓度是逐渐增大的,所以改变的条件不是浓度或压强,则改变的条件是升高温度,故选①、②;
B、图象B中改变条件后,A、B的浓度都突然增大,则改变的条件是缩小体积,即增大了压强,平衡正反应方向移动,故选③、①;
C、图象C中改变条件后,A、B的浓度都突然减小,则改变的条件是扩大体积,即减小了压强,减小压强平衡向体积增大的方向进行,即逆向进行,故选④、②;
D、图象D中改变条件后,A、B的浓度都减小,B的浓度突然减小,所以图示曲线是减小生成物B的浓度,平衡向正反应方向进行,故选⑤、①;
故答案为:
| 平衡移动的因素 | 平衡移动的方向 |
| ① | ② |
| ③ | ① |
| ④ | ② |
| ⑤ | ① |
点评 本题考查了化学平衡图象,注意准确把握温度、压强对平衡的影响是解决本题的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 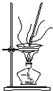 可用于除去碳酸钠固体中含有的少量碳酸氢钠 | |
| B. | 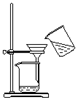 可用于碳酸钙固体和氯化钠溶液的分离 | |
| C. | 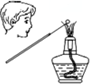 可正确观察钾元素焰色反应 | |
| D. | 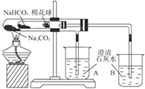 小试管中NaHCO3分解,(B)中澄清石灰水变浑浊,(A)中澄清石灰水没浑浊,说明稳定性Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.5mol•L-1氨水中所含NH4+数为0.5NA | |
| B. | 1molFe与足量氯气反应转移的电子数为2NA | |
| C. | 标准状况下,33.6LCO2约含有1.5NA个分子 | |
| D. | 1mol 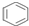 中含碳碳双键数为3NA 中含碳碳双键数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H++SO42-+Ba2++OH-→BaSO4↓+H2O | |
| B. | 2H++SO42-+Ba2++2OH-→BaSO4↓+2H2O | |
| C. | Mg2++H++2SO42-+2Ba2++3OH-→Mg(OH)2↓+2BaSO4↓+H2O | |
| D. | Mg2++2H++2SO42-+2Ba2++4OH-→Mg(OH)2↓+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 能源是当今社会发展的三大支柱之一,有专家指出:如果对燃料产物如CO2、H2O、N2等能够实现利用太阳能让它们重新组合(如图),可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化( )
能源是当今社会发展的三大支柱之一,有专家指出:如果对燃料产物如CO2、H2O、N2等能够实现利用太阳能让它们重新组合(如图),可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化( )| A. | 化学能 | B. | 热能 | C. | 生物能 | D. | 电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com