
某化学课外活动小组拟用Zn和稀H2SO4制取H2还原CuO,实验装置如下。
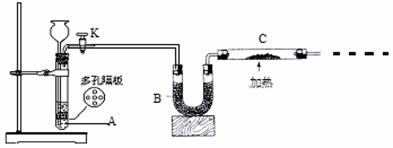
(1)按图连接好实验装置。检查装置的气密性,方法是
。
(2)A中反应的化学方程式为 ,C中反应的氧化剂是 ,B装置的作用是 。
(3)加热C处酒精灯之前必须进行的操作是(答详细的操作过程)
。
(4)C中固体加热前质量为mg,加热后质量为ng,则实验中实际消耗的H2质量为 g。
A.=(m-n)/8 B.=m/40 C.=n/32 D.> (m-n)/8
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:
某化学课外活动小组为了探究不同催化剂对氧化氢分解速率的影响,设计并进行了如下实验,请你完成下列各项任务。
I.氧化铜的制备。
(1)称取10g胆矾,将其放入小烧杯中,再溶于适量水配成溶液。
(2)向步骤(1)中的烧杯内滴加NaOH溶液,直至产生大量的沉淀。
(3)检验沉淀是否完全,其操作方法是 。
(4)将步骤(2)所得混合物加热至沉淀全部变为黑色。
(5)再将步骤(4)所得混合物 、洗涤、 后研细。本步骤中要验证是否洗净硫酸根离子的方法是: 。
II.比较不同催化剂对过氧化氢分解速率的影响。
该课外活动小组拟完成的实验及实验记录的表格如下,
拟采用下图所示装置来测定氧气的体积。

| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| ① | 15mL | 无 | |
| ② | 15mL | CuO(0.5g) | |
| ③ | 15mL | MnO2(0.5g) |
试回答下列问题:
(1)本实验中影响双氧水分解速率的因素有:①实验时的温度和压强;②双氧水的浓度
③不同的催化剂;④ ;⑤ 等。
(2)上述实验中的“待测数据”可以是 ;也可以是 。
(3)为探究CuO在实验②中是否起催化作用,除与①比较外,还需补做下列实验(不必写具体操作):①证明CuO的化学性质没有改变;② 。
(4)你认为可以使过氧化氢分解的催化剂还有 (填一种物质的化学式或名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
①称量CuSO4·5H2Om1g,在研钵中研细后,完全溶于适量水中;
②向盛硫酸铜溶液的烧杯内加入稍过量的NaOH溶液,使Cu2+完全沉淀;
③将烧杯内的悬浊液转移到蒸发皿中,小火加热至沸,搅拌,直到沉淀完全变为黑色;
④冷却后,过滤,并用蒸馏水洗涤沉淀2—3次;
⑤将固体充分干燥后,称量得CuO m2g,研细备用。
请回答:
(1)本实验多次用到玻璃棒,其作用分别为步骤①___________,步骤③___________,步骤④___________。
(2)步骤②中证明NaOH已足量的方法是_________________。
(3)步骤④中洗涤沉淀的操作为_________________,目的是___________________。
Ⅱ.该小组用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:
2 NH3+3CuO![]() N2+3Cu+3H2O
N2+3Cu+3H2O
请回答:
(1)如果选用测定生成物Cu和H2O的质量m(Cu)、m(H2O)时,请用下列仪器设计一个简单的实验方案。

①仪器连接的顺序(用字母编号表示,仪器可重复使用)_____________;d的作用是___________;b中试剂X的名称是___________。
②列出计算Cu的相对原子质量的表达式___________。
(2)①如果仍采用上述仪器装置,测定下列物理量也可以达到实验目的的有___________。
A.m(CuO)和m(H2O) B.V(N2)和m(CuO)
C.m(NH3)和m(H2O) D.m(CuO)和m(Cu)
②若可以增加仪器装置,为达到实验目的,上述A、B、C、D还可以选择___________;完成此选择的实验,应该增加的仪器是___________(选择装置代号)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com