
(14·Ö)ÓŠČżÖÖ½šŹōµ„ÖŹA”¢B”¢C£¬ĘäÖŠAµÄŃęÉ«·“Ó¦ĪŖ»ĘÉ«£¬B”¢CŹĒ³£¼ū½šŹō”£ČżÖÖ½šŹōµ„ÖŹA”¢B”¢CÄÜÓėĘųĢå¼×”¢ŅŅ”¢±ū¼°ĪļÖŹD”¢E”¢F”¢G”¢HÖ®¼ä·¢ÉśČēĻĀ×Ŗ»Æ¹ŲĻµ£ØĶ¼ÖŠÓŠŠ©·“Ó¦µÄ²śĪļŗĶ·“Ó¦µÄĢõ¼žĆ»ÓŠ±ź³ö£©”£
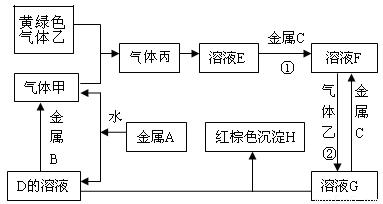
Ēėøł¾ŻŅŌÉĻŠÅĻ¢»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³öĻĀĮŠĪļÖŹµÄ»ÆѧŹ½£ŗ
A_____________£»H ______________£» G___________£»ŅŅ____________”£
£Ø2£©Š“³öĻĀĮŠ·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ
·“Ó¦¢Ł________________________________£»·“Ó¦¢Ś_________________________________”£
£Ø3£© ·“Ó¦¢ŚÖŠµē×Ó×ŖŅʵďżÄæĪŖ6.02”Į1023øöŹ±ĻūŗĵÄĘųĢåŅŅµÄĪļÖŹµÄĮæĪŖ mol
£Ø1£©Na£»£Ø2·Ö£© Fe(OH)3£»£Ø2·Ö£© FeCl3£»£Ø2·Ö£© Cl2 £Ø2·Ö£©
£Ø2£©Fe+2HCl=FeCl2+H2 ”ü £Ø2·Ö£©£»2FeCl2+Cl2==2 FeCl3 £Ø2·Ö£©£»£Ø3£©0.5mol£Ø2·Ö£©
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗøł¾ŻĢāŅāæÉÖŖ½šŹōAŹĒNa;½šŹōBŹĒAl£»½šŹōCŹĒFe£»ĘųĢå¼×ŹĒH2£»ĘųĢåŅŅŹĒCl2;ĘųĢå±ūŹĒHCl£¬ČÜŅŗDŹĒNaOH ; ČÜŅŗEŹĒŃĪĖį£»ČÜŅŗFŹĒFeCl2£»ČÜŅŗGŹĒFeCl3£»³ĮµķHŹĒFe(OH)3£»£Ø1£©ĻĀĮŠĪļÖŹµÄ»ÆѧŹ½·Ö±šŹĒ£ŗAŹĒNa£»HŹĒFe(OH)3£»GŹĒFeCl3£»ŅŅŹĒCl2; £Ø2£©·“Ó¦¢Ł»Æѧ·½³ĢŹ½ŹĒ£ŗFe+2HCl=FeCl2+H2”ü£»·“Ó¦¢Ś»Æѧ·½³ĢŹ½ŹĒ2FeCl2+Cl2==2 FeCl3 £»£Ø3£© ŌŚ·“Ó¦2FeCl2+Cl2==2 FeCl3 æÉÖŖĆæĻūŗÄ1molµÄĀČĘų£¬·¢ÉśŃõ»Æ»¹Ō·“Ó¦×ŖŅʵē×Ó2NA,Čōµē×Ó×ŖŅʵďżÄæĪŖ6.02”Į1023øöŹ±ĻūŗĵÄĘųĢåŅŅµÄĪļÖŹµÄĮæĪŖ0.5mol”£
æ¼µć£ŗæ¼²éŌŖĖŲ¼°»ÆŗĻĪļµÄĶʶĻ”¢ĪļÖŹµÄ»ÆѧŹ½µÄŹéŠ“”¢»Æѧ·½³ĢŹ½µÄŹéŠ“¼°Ńõ»Æ»¹Ō·“Ó¦µÄ¼ĘĖćµÄÖŖŹ¶”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014¼ŖĮÖŹ”³¤“ŗŹŠøßŅ»ĻĀŃ§ĘŚĘŚÄ©æ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠ×°ÖƵÄĻßĀ·½ÓĶØŗó,¾¹żŅ»¶ĪŹ±¼ä,ČÜŅŗµÄpHÖµĆ÷ĻŌĻĀ½µµÄŹĒ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014¼ŖĮÖŹ”°×³ĒŹŠø߶žÉĻŃ§ĘŚĘŚÄ©æ¼ŹŌ»ÆѧŹŌ¾ķ£ØA¾ķ£©£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
£Ø14·Ö£©
£Ø1£©“æĖ®ÖŠc(H£«)£½5.0”Į10£7mol/L£¬Ōņ“ĖŹ±“æĖ®ÖŠµÄc(OH£)£½ £»
ČōĪĀ¶Č²»±ä£¬µĪČėĻ”ĮņĖįŹ¹c(H£«)£½5.0”Į10£3mol/L£¬Ōņc(OH£)£½ ”£
£Ø2£©ŌŚCH3COONaµÄČÜŅŗÖŠ£¬ø÷Ąė×ÓµÄĪļÖŹµÄĮæÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ ”£
£Ø3£©Ć÷·ÆµÄĖ®ČÜŅŗĻŌĖįŠŌ£¬ĘäŌŅņŹĒ£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£© ”£
£Ø4£©ŌŚ25”ę”¢101kPaĻĀ£¬0.5molµÄ¼×“¼£ØCH3OH£©ĶźČ«Č¼ÉÕÉś³ÉCO2ŗĶŅŗĢ¬Ė®Ź±·Å³ö352kJµÄČČĮ棬Ōņ±ķŹ¾¼×“¼Č¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø5£©1L 1 mol”¤L£1 H2SO4ČÜŅŗÓė2L 1 mol”¤L£1 NaOHČÜŅŗĶźČ«·“Ó¦£¬·Å³ö114.6kJČČĮ棬Ōņ±ķŹ¾ÖŠŗĶČȵÄČČ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø6£©ŅŃÖŖ£ŗ¢Ł N2(g)+2O2(g)£½2NO2(g) ”÷H£½+67.7 kJ/mol £»
¢Ś N2H4(g)+O2(g)£½N2(g)+2H2O(g) ”÷H£½£534 kJ/mol
ŌņN2H4ÓėNO2ÓėĶźČ«·“Ӧɜ³ÉµŖĘųŗĶĘųĢ¬Ė®µÄČČ»Æѧ·½³ĢŹ½ĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014¼ŖĮÖŹ”°×³ĒŹŠø߶žÉĻŃ§ĘŚĘŚÄ©æ¼ŹŌ»ÆѧŹŌ¾ķ£ØA¾ķ£©£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠÓŠ¹ŲĪŹĢāÓėŃĪµÄĖ®½āĪŽ¹ŲµÄŹĒ£Ø £©
A£®NH4ClÓėZnCl2ČÜŅŗæÉ×÷ŗø½Ó½šŹōŹ±µÄ³żŠā¼Į
B£®ÓĆNaHCO3ÓėAl2(SO4)3Į½ÖÖČÜŅŗæÉÖĘ³ÉÅŻÄĆš»š¼Į
C£®³£ĪĀĻĀ²āµĆNaHSO3ČÜŅŗµÄpHŠ”ÓŚ7
D£®ŹµŃéŹŅŹ¢·ÅNa2CO3ČÜŅŗµÄŹŌ¼ĮĘæ²»ÄÜÓĆÄ„æŚ²£Į§Čū
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014¼ŖĮÖŹ”°×³ĒŹŠø߶žÉĻŃ§ĘŚĘŚÄ©æ¼ŹŌ»ÆѧŹŌ¾ķ£ØA¾ķ£©£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A£®²ŻĖįĒā¼ŲČÜŅŗ³ŹĖįŠŌ£¬ŌŚ0.1mol”¤L£1KHC2O4ČÜŅŗÖŠ£ŗc£ØC2O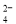 £©>c£ØH2C2O4£©
£©>c£ØH2C2O4£©
B£®ŌŚŠ”ĖÕ“ņĖ®ČÜŅŗÖŠ£ŗc£ØNa+£©+c£ØH+£©=c£ØHCO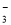 £©+c£ØCO
£©+c£ØCO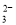 £©+c£ØOH££©
£©+c£ØOH££©
C£®ĻąĶ¬ĪĀ¶ČĻĀ£¬1 mol/L°±Ė®ČÜŅŗÓė0.5mol/L°±Ė®ČÜŅŗÖŠ£¬c£ØOH££©Ö®±ČŹĒ2:1
D£®µ±°±Ė®ÓėŃĪĖįĒ”ŗĆĶźČ«·“Ó¦Ź±£¬c£ØNH £©>c£ØCl?£©>c£ØH+£©>c£ØOH?£©
£©>c£ØCl?£©>c£ØH+£©>c£ØOH?£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014¼ŖĮÖŹ”°×³ĒŹŠøßŅ»ÉĻŃ§ĘŚĘŚÄ©æ¼ŹŌ»Æѧ£ØB¾ķ£©ŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
¹Å“śĘ÷ĪļÉĻµÄŃÕĮĻÖĮ½ńɊƻӊ·¢ĻÖĘä×ŌČ»“ęŌŚµÄ¼ĒŌŲ”£20ŹĄ¼Ķ80Äź“śæĘѧ¼Ņ½ųŠŠ³¬µ¼²ÄĮĻŃŠ¾æŹ±£¬Å¼Č»·¢ĻÖĘä³É·ÖĪŖ×ĻÉ«µÄ¹čĖįĶ±µ(»ÆѧŹ½£ŗBaCuSi2Ox£¬CuĪŖ£«2¼Ū)£¬ĻĀĮŠÓŠ¹Ų”°ŗŗ×Ļ”±µÄĖµ·ØÖŠ²»ÕżČ·µÄŹĒ
A£®ÓĆŃĪµÄŠĪŹ½±ķŹ¾£ŗ BaSiO3”¤CuSiO3 B£®ÓĆŃõ»ÆĪļŠĪŹ½±ķŹ¾£ŗBaO”¤CuO”¤2SiO2
C£®Ņ×ČÜÓŚĒæĖį”¢Ēæ¼ī D£®ŠŌÖŹĪČ¶Ø£¬²»Ņ×ĶŹÉ«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014¼ŖĮÖŹ”°×³ĒŹŠøßŅ»ÉĻŃ§ĘŚĘŚÄ©æ¼ŹŌ»Æѧ£ØB¾ķ£©ŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
Ėę×ÅČĖĆĒÉś»ī½Ś×ąµÄ¼Óæģ£¬·½±ćµÄŠ”°ü×°Ź³Ę·Ņѱ»¹ć·ŗ½ÓŹÜ”£ĪŖĮĖŃÓ³¤Ź³Ę·µÄ±£ÖŹĘŚ£¬·ĄÖ¹Ź³Ę·ŹÜ³±¼°ø»Ö¬Ź³Ę·Ńõ»Æ±äÖŹ£¬ŌŚ°ü×°“üÖŠÓ¦·ÅČėµÄ»ÆѧĪļÖŹŹĒ
A£®ĪŽĖ®ĮņĖįĶ”¢ÕįĢĒ B£®¹č½ŗ”¢ĮņĖįŃĒĢś
C£®Ź³ŃĪ”¢ĮņĖįŃĒĢś D£®ÉśŹÆ»Ņ”¢Ź³ŃĪ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014¼ŖĮÖŹ”°×³ĒŹŠøßŅ»ÉĻŃ§ĘŚĘŚÄ©æ¼ŹŌ»Æѧ£ØA¾ķ£©ŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
³£ĪĀĻĀ£¬ŌŚĖ®ČÜŅŗÖŠ·¢ÉśČēĻĀ·“Ó¦£ŗ£Ø £©
¢Ł16H++10C£+2XO4 £ = 2X2+£«5C2£«8H2O£»¢Ś2A2+£«B2 = 2A3+£«2B££»¢Ū2B££«C2 = B2£«2C£”£
ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
A£®·“Ó¦C2 £« 2A2+ = 2A3+ £« 2C£ æÉŅŌ½ųŠŠ
B£®»¹ŌŠŌÓÉĒæµ½ČõµÄĖ³ŠņŹĒC£>A2+>B£>X2+
C£®Ńõ»ÆŠŌÓÉĒæµ½ČõµÄĖ³ŠņŹĒXO4£ >C2>B2>A3+
D£®·“Ó¦¢ŪŹĒÖĆ»»·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014¼ŖĮÖŹ”ø߶žĻĀŃ§ĘŚĘŚÄ©æ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
øßĢśĖį¼Ų(K2FeO4)ŹĒŅ»ÖÖŠĀŠĶ”¢øߊ§”¢¶ą¹¦ÄÜĖ®“¦Ąķ¼Į£¬ĘäÓėĖ®µÄĄė×Ó·“Ó¦ŹĒ£ŗ
4FeO42£+10H2O=4Fe(OH)3(½ŗĢå)+3O2”ü+8OH£
¹¤ŅµÉĻĻČÖʵĆøßĢśĖįÄĘ£¬Č»ŗóŌŚµĶĪĀĻĀ£¬ĻņøßĢśĖįÄĘČÜŅŗÖŠ¼ÓČėŅ»¶ØĮæµÄKOH¾ĶæÉÖʵĆøßĢśĖį¼Ų”£ÖʱøøßĢśĖįÄʵÄĮ½ÖÖ·½·ØµÄÖ÷ŅŖ·“Ó¦ŌĄķČēĻĀ£ŗ
ŹŖ·ØÖʱø”Ŗ”Ŗ2Fe(OH)3+3ClO£+4OH£=2FeO42£+3Cl£+5H2O£»
øÉ·ØÖʱø”Ŗ”Ŗ2FeSO4 +6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2”ü”£
ĻĀĮŠÓŠ¹ŲĖµ·ØÖŠ“ķĪóµÄŹĒ£Ø””””£©
A£®øßĢśĖį¼ŲÓėĖ®·“Ó¦Ź±£¬Ė®·¢ÉśŃõ»Æ·“Ó¦
B£®øÉ·ØÖŠĆæÉś³É1mol Na2FeO4¹²×ŖŅĘ4molµē×Ó
C£®ŹŖ·ØÖŠĆæÉś³É1mol Na2FeO4¹²×ŖŅĘ3molµē×Ó
D£®K2FeO4“¦ĄķĖ®Ź±£¬²»½öÄÜɱ¾ś£¬»¹ÄܳżČ„H2S”¢NH3µČ£¬²¢Ź¹Šüø”ŌÓÖŹ³Į½µ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com