
实验设计:自然界矿物中一种重晶石矿的主要成分是BaSO4,它不溶于任何酸、碱和水,纯净的BaSO4可供医疗等方面应用。某课外活动小组同学用重晶石矿和焦炭为原料制取纯净BaSO4的(设矿物中杂质不与焦炭反应,也不溶于水)部分流程如下:
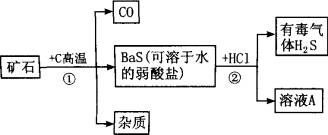
按要求填空:
(1)在步骤①中,________元素的化合价升高了,________元素的化合价降低了。
(2)写出步骤②中溶液A的溶质的化学式________。
(3)写出利用A溶液制取Ba(OH)2的化学方程式________。
(4)有同学指出,上述步骤②产生有毒气体 H2S,应将方法加以改进,请你提出改进意见,使该实验既不产生H2S,又能获得纯净BaSO4。请写出有关化学方程式。
解题思路:(1)反应①实质为: (2)BaS是可溶于水的弱酸盐,故反应②实质为:BaS+2HCl══H2S↑+BaCl2,所以A中溶质为BaCl2。 (3)制碱的途径有: ①盐+碱→新盐+新碱 则有BaCl2+ R(OH)n→RCln+Ba(OH)2 据氯化物及相应氢氧化物的溶解性知①途径不行。 ②碱性氧化物(可溶于水)+H2O→碱,则有BaO+H2O══Ba(OH)2 反推②途径:Ba(OH)2→BaO→BaCO3→BaCl2 设计如下流程:BaCl Ba(OH) 有关化学方程式如下:BaCl2+Na2CO3══BaCO3↓+2NaCl
BaO+H2O══Ba(OH)2 (4)要使②反应不产生H2S,需使S2-形成硫化物沉淀,试剂应以可溶性氯化物代替盐酸,且其相应阳离子能与S2-形成不溶性金属硫化物。 BaS+CuCl2══BaCl2+CuS↓过滤 BaCl2+H2SO4══BaSO4↓+2HCl蒸发→结晶→干燥 参考答案:(1)CS (2)BaCl2 (3)(4)见“解题思路”
|


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:物理教研室 题型:022

按要求填空:
(1)在步骤①中,________元素的化合价升高了,________元素的化合价降低了。
(2)写出步骤②中溶液A的溶质的化学式________。
(3)写出利用A溶液制取Ba(OH)2的化学方程式________。
(4)有同学指出,上述步骤②产生有毒气体 H2S,应将方法加以改进,请你提出改进意见,使该实验既不产生H2S,又能获得纯净BaSO4。请写出有关化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,则氧化剂与氧化产物的物质的量之比为 ▲ 。
(2)上述反应中产生的气体可用 ▲ 吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—= 2H3AsO4+ 3S+10NO2↑+2H2O
若生成48g S,则生成标准状况下的NO2的体积为 ▲ L。若准确测得的实际体积小于理论值(计算值),请分析可能原因 ▲ 。
(4)某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO。其实验流程图如下:
①测定硝酸的物质的量:
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为 ▲ 。
②测定NO的体积:
若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过程中
▲ (填“有”或“没有”)NO产生,作此判断的依据是 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省扬州中学高三12月练习测试化学试卷 题型:填空题
(14分)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,则氧化剂与氧化产物的物质的量之比为 。
(2)上述反应中产生的气体可用 吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3— = 2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成48g S,则生成标准状况下的NO2的体积为 L。若准确测得的实际体积小于理论值(计算值),请分析可能原因 。
(4)某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO。其实验流程图如下:
①测定硝酸的物质的量:
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为 。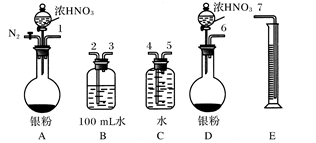
②测定NO的体积:
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中 (填“有”或“没有”)NO产生,作此判断的依据是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三12月练习测试化学试卷 题型:填空题
(14分)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,则氧化剂与氧化产物的物质的量之比为 ▲ 。
(2)上述反应中产生的气体可用 ▲ 吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3— = 2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成48g S,则生成标准状况下的NO2的体积为 ▲ L。若准确测得的实际体积小于理论值(计算值),请分析可能原因 ▲ 。
(4)某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO。其实验流程图如下:
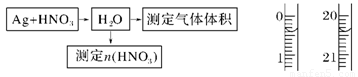
①测定硝酸的物质的量:
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为 ▲ 。
②测定NO的体积:
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中
▲ (填“有”或“没有”)NO产生,作此判断的依据是 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com