

分析 KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀是Al2O3和Fe2O3;
向沉淀中加NaOH溶液,Fe2O3不反应,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中适量盐酸可得Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中剩余的是K2SO4、(NH4)2SO4和NH3•H2O,以此来解答.
解答 解:KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后,溶液中是KAl(SO4)2,沉淀C是Al2O3和Fe2O3;
向沉淀中加NaOH溶液,Fe2O3不反应,则沉淀D为Fe2O3,Al2O3可与NaOH溶液反应生成NaAlO2,向NaAlO2溶液中适量盐酸可得Al(OH)3沉淀,Al(OH)3受热分解生成B为Al2O3;
向溶液中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中E是K2SO4、(NH4)2SO4和NH3•H2O,
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是过滤,需要的仪器为漏斗、烧杯、玻璃棒等,故答案为:过滤;漏斗、烧杯、玻璃棒;
(2)固体B为Al2O3,沉淀D为Fe2O3,溶液E为K2SO4、(NH4)2SO4和NH3•H2O,故答案为:Al2O3;Fe2O3;K2SO4、(NH4)2SO4和NH3•H2O;
(3)①、②、③、④四个反应的离子方程式分别为①Al2O3+2OH-+3H2O═2[Al(OH)4]-、②Al3++3NH3•H2O═Al(OH)3↓+3NH4+、③[Al(OH)4]-+H+═Al(OH)3↓+H2O、④2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:Al2O3+2OH-+3H2O═2[Al(OH)4]-;Al3++3NH3•H2O═Al(OH)3↓+3NH4+;[Al(OH)4]-+H+═Al(OH)3↓+H2O;2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
点评 本题考查物质的分离方法及选择,为高频考点,把握物质的性质及混合物分离提纯方法等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:多选题
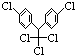 ,有关它的说法正确的是( )
,有关它的说法正确的是( )| A. | 它属于芳香烃 | B. | 分子中最多有23个原子共面 | ||
| C. | 分子式为C14H8Cl5 | D. | 1 mol该物质能与6 molH2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol水的摩尔质量和1 mol水的摩尔质量 | |
| B. | 1 mol/L氯化钙溶液中n(Cl-)和2 mol/L氯化钾溶液中n(Cl-) | |
| C. | 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数 | |
| D. | 20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 、
、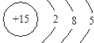 、其最高价氧化物对应的水化物的化学式H3PO4、其气态氢化物的分子空间构型为三角锥形.
、其最高价氧化物对应的水化物的化学式H3PO4、其气态氢化物的分子空间构型为三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75% | 11.44% | 13.56% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取代,4 mol Cl2 | B. | 加成、取代,3 mol Cl2 | ||
| C. | 加成,2 mol Cl2 | D. | 加成、取代,5 mol Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 利用腐蚀法制作印刷线路板:Fe3++Cu=Fe2++Cu2+ | |
| C. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| D. | 用液溴和苯在催化剂作用下制溴苯: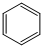 +Br2$\stackrel{催化剂}{→}$ +Br2$\stackrel{催化剂}{→}$ +HBr +HBr |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com