
| A. | a的值为3 | B. | 平衡时X的浓度为0.8mol/L | ||
| C. | Y的转化率为60% | D. | 反应速率v(Y)=0.2mol/(L•min) |
分析 A.根据n=cV计算生成的Q的物质的量,再根据物质的量之比等于化学计量数之比计算a的值;
B.根据生成的n(Z),利用物质的量之比等于化学计量数之比计算参加反应的X的物质的量,进而计算平衡时X的物质的量,再根据c=$\frac{n}{V}$计算;
C.根据生成的n(Z),利用物质的量之比等于化学计量数之比计算参加反应的Y的物质的量,再根据转化率定义计算;
D.根据V=$\frac{△c}{△t}$计算.
解答 解:A.平衡时生成0.8mol Z,测得Q的浓度为0.6mol•L-1,则生成的n(Q)=0.6mol•L-1×2L=1.2mol,所以2:a=0.8mol:1.2mol,解得a=3,故A正确;
B.平衡时生成0.8molZ,则参加反应的X的物质的量为0.8mol×$\frac{1}{2}$=0.4mol,故平衡时X的物质的量为2mol-0.4mol=1.6mol,平衡时X的浓度为 $\frac{1.6mol}{2L}$=0.8mol/L,故B正确;
C.平衡时生成0.8molZ,则参加反应的Y的物质的量为0.8mol×$\frac{3}{2}$=1.2mol,故Y的转化率为 $\frac{1.2mol}{2mol}$×100%=60%,故C正确;
D.平衡时生成0.8molZ,则参加反应的Y的物质的量为0.8mol×$\frac{3}{2}$=1.2mol,所以v(Y)=$\frac{△c}{△t}$=$\frac{\frac{1.2}{2}}{2}$=0.3mol/(L•min),故D错误,
故选:D.
点评 本题考查化学平衡的有关计算,难度中等,注意对基础知识的理解掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{3(a+b)}{b-a}$ | B. | $\frac{16(b+a)}{b-a}$ | C. | $\frac{8(b-a)}{b+a}$ | D. | $\frac{16(b-a)}{b+a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| B. | PH=1的亚硫酸溶液中含有的H+数目为0.1NA | |
| C. | 2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1Na | |
| D. | 0.1 mol的Na2O2中含阴离子数是0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
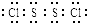 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
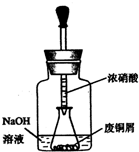 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(H2)═0.3 mol/(L•min) | B. | V(N2)═0.1mol/(L•min) | ||
| C. | V(NH3)═0.15mol/(L•min) | D. | V(N2)═0.2mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 504mL | B. | 168mL | C. | 336mL | D. | 224mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 人们对苯的认识有一个不断深化的过程.
人们对苯的认识有一个不断深化的过程.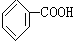 和生石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式:
和生石灰的混合物得到液体,命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式: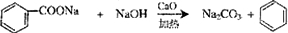 (NaOH参与反应)
(NaOH参与反应)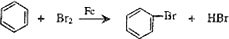
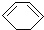 )脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”).
)脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com