
| A. | 3.01×1023个CH4分子 | B. | 4℃时23.4mL H2O | ||
| C. | 23g C2H5OH | D. | 常温常压下22.4LNH3 |
分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算物质的量,并结合物质的构成计算氢原子的物质的量,H原子物质的量越大,原子个数越多,常温常压下气体的气体摩尔体积大于22.4L/mol,以此来解答.
解答 解:A.n(CH4)=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}/mol}$=0.5mol,含氢原子2mol;
B.4℃时23.4mL H2O的质量为23.4mL,n(H2O)=$\frac{23.4g}{18g/mol}$=1.3mol,含氢原子2.6mol;
C.n(C2H5OH)=$\frac{23g}{46g/mol}$=0.5mol,含氢原子3mol;
D.常温常压下气体的气体摩尔体积大于22.4L/mol,则常温常压下22.4LNH3的物质的量小于1mol,含有氢原子小于3mol.
故选C.
点评 本题考查物质的量的计算,把握质量、微粒数、体积、物质的量的关系及分子的构成为解答的关键,注意标况下水为液体为解答的易错点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 羟胺(NH2OH)是一种不稳定的白色大片状或针状结晶.极易吸潮,极易溶于水,在热水中易分解.回答下列问题:
羟胺(NH2OH)是一种不稳定的白色大片状或针状结晶.极易吸潮,极易溶于水,在热水中易分解.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
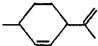 名称叫l,8一萜二烯,可从柑橘中提取,下列说法不正确的是( )
名称叫l,8一萜二烯,可从柑橘中提取,下列说法不正确的是( )| A. | 其分子式为C10H15 | B. | 常温下它呈液态,难溶于水 | ||
| C. | 其一氯代物有8种 | D. | 能与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ab}{2V}$mol.L-1 | B. | $\frac{ab}{2000V}$mol.L-1 | C. | $\frac{250ab}{V}$mol.L-1 | D. | $\frac{ab}{80V}$mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1molN2含有NA个分子 | |
| B. | 标准状况下,22.4LCH4含有约4NA个氢原子 | |
| C. | 1molK2SO4溶于足量的水中后,溶液中含有2NA个K+ | |
| D. | 1molCH4比1molH2O的分子数多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 40% | C. | 58.6% | D. | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com