
| A����֪2C��s��+2O2��g��=2CO2��g������H1 2C��s��+O2��g��=2CO��g������H2 ���H1����H2 |
| B����ϡ��Һ�У�H+��aq��+OH-��aq��=H2O��l������H=-57.3kJ/mol����40.0 g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�С��57.3 kJ������ |
| C����C��ʯī��=C�����ʯ������H=+1.9 kJ/mol����֪���ʯ��ʯī�ȶ� |
| D����101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2��g��+O2��g��=2H2O��l����H=-285.8kJ/mol |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�����յõ���������������
| ||
B���ñ�����Һ�����ٷֱ�Ũ��Ϊ��
| ||
| C������������ҺPH���� | ||
D���ñ�����Һ���������ʵ���Ũ��Ϊ��
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Cl2ͨ��FeCl2��Һ�� |
| B��CO2ͨ��Ca��OH��2��Һ�� |
| C����AlCl3��Һ���� NaOH ��Һ�� |
| D��CO2ͨ��BaCl2��Һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1mol CH2=CH2������Br2�����ӳɷ�Ӧ������1 mol Br2 |
| B��������λ��Ԫȡ����ֻ��һ�֣�����˵�������Ӳ�����̼̼������̼̼˫���Ľ���ṹ |
| C���ױ�������ԭ�Ӷ���ͬһƽ���� |
D������ϩ�� -CH=CH2���������飨 -CH=CH2���������飨 ����Ϊͬ���칹�� ����Ϊͬ���칹�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
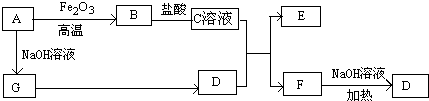
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����FeCl3��Һ�м���������ۣ���Һ���ػ�ɫ��Ϊdz��ɫ |
| B��������ˮ��Ӧ����������������ˮ���� |
| C��Ҫ֤��Fe3+��Һ�к���Fe2+���Լ�KSCN��Һ����ˮ�õ���ɫ��Һ |
| D�������Ʒ���FeCl3��Һ�У��Ȱ�Fe3+��ԭ��Fe2+������ٻ�ԭΪFe���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| CuCl2 |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��3�� | B��4�� | C��5�� | D��6�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com