
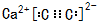 .
.分析 (1)钠在周期表中的位置是第三周期第IA族,钠易与水和氧气反应,所以要隔绝空气、水保存;
(2)CaC2是离子化合物,存在离子键和共价键;
(3)电石和金属钠都易与水反应生成可燃性气体,且放出大量热;
(4)①NaCN是强碱弱酸盐,氢氰根离子水解而使其水溶液呈碱性;
②用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,说明二者反应生成氨气、和碳酸氢钠;
③用硫代硫酸钠中和的离子方程式为CN-+S2O32-→A+SO32-,根据元素守恒、转移电子守恒判断产物;
④根据信息:CN-能够被氧气氧化成HCO3-,同时生成NH3来书写方程式;
(5)非金属性强的元素显示负价,非金属性弱的则显示正价;非金属的非金属越强,其最高价氧化物的水化物酸性越强.
解答 解:(1)钠在周期表中的位置是第三周期第IA族,钠易与水和氧气反应,所以要隔绝空气、水保存,
煤油和钠不反应且密度小于钠,所以钠可保存在煤油中,故答案为:第三周期第IA族;煤油;
(2)CaC2是离子化合物,存在离子键和共价键,其电子式为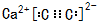 ,故答案为:
,故答案为: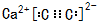 ;
;
(3)电石和金属钠都易与水反应生成可燃性气体,且放出大量热,2Na+2H2O=2NaOH+H2↑、CaC2+2H2O=Ca(OH)2+C2H2↑,故答案为:2Na+2H2O=2NaOH+H2↑、CaC2+2H2O=Ca(OH)2+C2H2↑,电石和金属钠都易与水反应生成可燃性气体,且放出大量热;
(4)①氰化钠为强碱弱酸盐,水解反应为:CN-+H2O?HCN+OH-,溶液呈碱性,
故答案为:CN-+H2O?HCN+OH-;
②用双氧水处理氰化钠,产生一种能使湿润的红色石蕊试纸变蓝的气体为氨气,根据原子守恒一种酸式盐为碳酸氢钠,所以反应为:NaCN+H2O2+H2O═NaHCO3+NH3↑,
故答案为:NaCN+H2O2+H2O═NaHCO3+NH3↑;
③CN-+S2O32-═A+SO32-,根据电荷守恒,A为-1价的阴离子,根据原子守恒,A中含有1个硫原子、1个碳原子、1个氮原子,所以A为:SCN-,
故答案为:SCN-;
④CN-能够被氧气氧化成HCO3-,同时生成NH3得出方程式为:2CN-+4H2O+O2$\frac{\underline{\;微生物\;}}{\;}$2HCO3-+2NH3,
故答案为:2CN-+4H2O+O2$\frac{\underline{\;微生物\;}}{\;}$2HCO3-+2NH3;
(5)CN-中C元素显+2价,N元素显-3价,说明N非金属性强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,其检验方法为:取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C;
故答案为:>;取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明酸性硝酸大于碳酸,则非金属性N>C.
点评 本题考查较综合,涉及非金属性强弱判断、氧化还原反应、盐类水解等知识点,为高频考点,明确物质性质、元素周期律、氧化还原反应基本原理等知识点即可解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若c(CH3COOH)=0.1mol/L,反应后的溶液中:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) | |
| B. | 若c(CH3COOH)=0.1mol/L,反应后的溶液中:c(OH-)>c(CH3COOH)+c(H+) | |
| C. | 若c(CH3COOH)=0.2mol/L,反应后的溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+) | |
| D. | 若反应后的溶液呈中性,则:c(CH3COOH)+c(CH3COO-)>0.05mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、BaCl2 | B. | HCl、KNO3 | C. | HCl、Na2CO3 | D. | Na2CO3、KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol A+1mol B | |
| B. | 1mol C+1mol D | |
| C. | 2mol C+2mol D | |
| D. | 0.5mol A+0.5mol B+0.5mol C+1mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | AlCl3 | B. | Na2CO3 | C. | Na2SO3 | D. | MgSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com