
【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究。
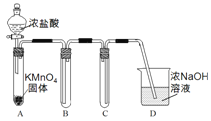
Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用右图装置及试剂制备并收集适量Cl2,装置B、C的作用分别是___________、_______________。
(2)制得的氯气中加入适量水,得到饱和氯水,饱和氯水中含氯元素的微粒有____________(写出全部微粒)。
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
①滤液漂白性增强的原因是________________(用化学平衡移动原理解释)。
②饱和氯水与石灰石反应生成HC1O的方程式是___________________。
Ⅱ. ClO3—、Cl—和H+反应的探究
(4)KClO3、KCl与硫酸可以反应。该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | (____)mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的_______________________。
②烧杯3取用硫酸的体积应为______________mL。
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2______________________。
【答案】收集氯气 防止D中的溶液进入B Cl2 、Cl—、ClO—、HClO Cl2 + H2O![]() HClO+HCl,CaCO3与盐酸反应使平衡正移,增大HClO的浓度,漂白效果增强 CaCO3+2Cl2 +H2O==2 HC1O + CO2+ CaCl2 其他条件相同时,氢离子浓度不同对化学反应速率的影响 5 收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化
HClO+HCl,CaCO3与盐酸反应使平衡正移,增大HClO的浓度,漂白效果增强 CaCO3+2Cl2 +H2O==2 HC1O + CO2+ CaCl2 其他条件相同时,氢离子浓度不同对化学反应速率的影响 5 收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化
【解析】
试题(1)氯气的密度比空气大,用向上排空气法收集,所以装置B的作用为收集氯气,氯气有毒,用NaOH溶液进行尾气吸收,为防止倒吸,装置C的作用是防止D中的溶液进入B。
(2)氯气溶于水并与水发生反应,Cl2+H2O![]() H++Cl-+HClO,得到的氯水呈黄绿色,说明含有Cl2,所以饱和氯水中含氯元素的微粒有Cl—Cl2ClO—HClO。
H++Cl-+HClO,得到的氯水呈黄绿色,说明含有Cl2,所以饱和氯水中含氯元素的微粒有Cl—Cl2ClO—HClO。
(3)①Cl2 + H2O![]() HClO+HCl;CaCO3与盐酸反应使平衡正移,增大HClO的浓度,漂白效果增强,所以在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
HClO+HCl;CaCO3与盐酸反应使平衡正移,增大HClO的浓度,漂白效果增强,所以在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
②根据上述现象,饱和氯水与石灰石反应生成HC1O的方程式是CaCO3+2Cl2 +H2O==2 HC1O + CO2+ CaCl2。
(4)①根据表格提供的信息,该反应在常温下进行,温度相同,每次试验时,氯酸钾溶液和氯化钾溶液的浓度相同,只有硫酸的用量不同,即氢离子浓度不同,所以该系列实验的目的是其他条件相同时,氢离子浓度不同对化学反应速率的影响;
②根据表格提供的信息,混合溶液的总体积均为9mL,所以烧杯3取用硫酸的体积应为9-1-3=5mL。
(5)因为ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色,所以要验证Cl2中是否含有ClO2,简单的操作为收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化即可。


科目:高中化学 来源: 题型:
【题目】近年我国高铁迅猛发展,为人们的出行带来了极大的便利。曾经利用如下反应焊接铁轨:2Al+Fe2O3 ![]() 2Fe + Al2O3 。请回答下列问题:
2Fe + Al2O3 。请回答下列问题:
(1)该反应属于_______________反应(填“放热”或“吸热”)。
(2)该反应的反应类型是_______________(填字母)。
A.化合反应 B.置换反应C.复分解反应 D.分解反应
(3)该反应中的氧化剂是_______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。请回答:

(1)装置A中发生反应的化学方程式:_________。
(2)装置D中试管口放置浸有NaOH溶液的棉花,其作用是______。
(3)装置B中应放置的液体是______。
(4)反应完毕,发现烧瓶中有铜片剩余,下列药品中能用来证明反应结束后的烧瓶中确有余酸的是______(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是
A.CH4+2O2![]() CO2+2H2O
CO2+2H2O
B.CH2=CH2+H2![]() CH3CH3
CH3CH3
C.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.![]() +HO-NO2
+HO-NO2![]()
 +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质常温下发生水解,对应的离子方程式正确的是
A.Na2CO3:CO32-+2H2O![]() H2O+CO2↑+2OH-
H2O+CO2↑+2OH-
B.NH4Cl:NH4++H2O![]() NH3·H2O+OH-
NH3·H2O+OH-
C.CuSO4:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
D.NaF:F-+H2O=HF+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应Cu+2FeCl3=CuCl2+2FeCl2,设计一个原电池。
(1)选用____为负极,___为正极,电解质溶液为_____。
(2)写出电极反应式:负极_____,正极_____。
(3)画出装置图: ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g)![]() 2C(g),△H=-QkJ/mol有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2kJ;已知Q1=3Q2。下列叙述不正确的是
2C(g),△H=-QkJ/mol有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2kJ;已知Q1=3Q2。下列叙述不正确的是
A. 甲中A的转化率为75%
B. Q1+Q2=Q
C. 达到平衡后,再向乙中加入0.25 mol A、0.75 mol B、1.5 mol C,平衡向正反应方向移动
D. 乙中的热化学方程式为2C(g)![]() A(g)+3B(g) ΔH=+Q2kJ/mol
A(g)+3B(g) ΔH=+Q2kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R五种元素的原子序数依次增大.其中:X的最外层电子排布为![]() ;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族。
;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族。
请回答下列问题:
![]() 元素基态原子的电子排布式为 ______ ,它的最高价氧化物的水化物的化学式为 ______ 。
元素基态原子的电子排布式为 ______ ,它的最高价氧化物的水化物的化学式为 ______ 。
![]() 分子的立体构型是 ______ ,中心原子的杂化方式是 ______ 。
分子的立体构型是 ______ ,中心原子的杂化方式是 ______ 。
![]() 与氮元素形成的一种化合物晶胞如图所示,该化合物的化学式为 ______。该晶体中与氮原子距离相等且最近的氮原子有 ______ 个。
与氮元素形成的一种化合物晶胞如图所示,该化合物的化学式为 ______。该晶体中与氮原子距离相等且最近的氮原子有 ______ 个。

![]() 化合物
化合物![]() 熔点为
熔点为![]() ,沸点为
,沸点为![]() ,熔融态不导电,可知
,熔融态不导电,可知![]() 的晶体类型是 ______
的晶体类型是 ______ ![]() 与热水反应的化学方程式为 ______ 。
与热水反应的化学方程式为 ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com