
【题目】已知:pAg=-lg[c(Ag+)]。Ksp(AgCl)=1×10-10,Ksp(AgI)=1×10-17。如图是向10mlAgNO3溶液中加入0.1molL-1溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像![]() 实线
实线![]() 。根据图像所得下列结论正确的是( )
。根据图像所得下列结论正确的是( )
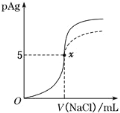
A.原AgNO3溶液的物质的量浓度为0.1molL-1
B.图中x点表示溶液中c(Ag+)= c(Cl-)
C.图中x点的坐标为(10,5)
D.把NaCl溶液换成0.1molL-1的NaI溶液,则图像在终点后变为虚线部分
【答案】B
【解析】
A.根据pAg=-lg[c(Ag+)]求出Ag+的浓度;
B. x点c(Ag+)=10-5mol/L,结合Ksp(AgCl)进行计算;
C. x点c(Ag+)=10-5mol/L,根据硝酸银的物质的量求出消耗的氯化钠的体积;
D.由于Ksp(AgI)< Ksp(AgCl),因此c(Ag+)减小。
A. 图中O点处pAg=0,因此c(Ag+)=100mol/L=1mol/L,即原AgNO3溶液的物质的量浓度为1mol/L,A项错误;
B. x点c(Ag+)=10-5mol/L,c(Cl-)=![]() =1×10-5mol/L,因此c(Ag+)= c(Cl-),B项正确;
=1×10-5mol/L,因此c(Ag+)= c(Cl-),B项正确;
C. x点c(Ag+)=10-5mol/L,沉淀完全,那么n(NaCl)=n(AgNO3)=0.01L×1mol/L=0.01mol,则V(NaCl)=![]() =0.1L=100mL,因此x点的坐标为(100,5),C项错误;
=0.1L=100mL,因此x点的坐标为(100,5),C项错误;
D. 由于Ksp(AgI)< Ksp(AgCl),因此c(Ag+)减小,把NaCl溶液换成0.1molL-1的NaI溶液,pAg更大,图象不是虚线图象,D项错误;
答案选B。


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】已知反应![]() ,某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
,某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
t/min | 2 | 4.5 | 5 | 6 |
X的转化率 | 30% | 40% | 70% | 70% |
A.随着反应的进行,混合气体的密度不断增大
B.反应在5.5min时,![]()
C.6min时,容器中剩余1.4molY
D.其他条件不变,将X的物质的量改为10mol,则可得到4molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以磷石膏![]() 主要成分CaSO4,杂质SiO2、Al2O3等
主要成分CaSO4,杂质SiO2、Al2O3等![]() 为原料可制备轻质CaCO3。
为原料可制备轻质CaCO3。
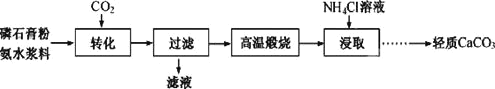
“转化”步骤中浆料清液的pH和c(SO42-)随时间变化如图,下列说法正确的是
A.为提高磷石膏粉的转化率,应通入过量的CO2
B.“转化”步骤,应控制溶液的pH约为7
C.高温煅烧时可发生反应![]() ,从而除去SiO2杂质
,从而除去SiO2杂质
D.向浸取液中通入CO2,可沉淀出几乎所有钙元素,后经过滤、洗涤、烘干即可获得轻质CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是
A. 饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
B. 25℃时,FeS的溶解度大于CuS的溶解度
C. 向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D. 向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() 在5L的密闭容器中进行,0~30s内,C的物质的量增加了0.30mol。下列叙述正确的是( )
在5L的密闭容器中进行,0~30s内,C的物质的量增加了0.30mol。下列叙述正确的是( )
A.容器中D的物质的量至少为0.45mol
B.0~30s内,A的平均反应速率是0.010 mol·L-1·s-1
C.容器中A、B、C、D的物质的量之比一定是4:5:4:6
D.容器中A的物质的量一定增加了0.30mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业生产食品香精菠萝酯(![]() )的简易流程如图:
)的简易流程如图:
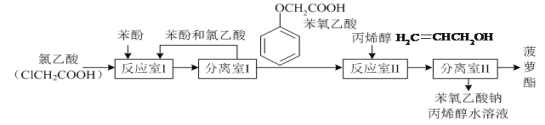
有关物质的熔、沸点如表:
苯酚 | 氯乙酸 | 苯氧乙酸 | |
熔点/℃ | 43 | 62 | 99 |
沸点/℃ | 181.9 | 189 | 285 |
试回答下列问题:
(1)反应室I中反应的最佳温度是104℃,为较好地控制温度在102℃~106℃之间,加热时可选用________(选填字母)。
A.火炉直接加热 B.水浴加热 C.油浴加热.
(2)分离室I采取的操作名称是__________。
(3)苯氧乙酸含氧官能团的名称__________。
(4)下列叙述错误的是_________。
A.反应室I产物中残留的苯酚可用FeCl3溶液检验
B.反应室Ⅱ产物中残留的丙烯醇可用溴水检验
C.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
D.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
(5)反应室I中发生反应的化学方程式是______。
(6)分离室Ⅱ的操作为:①用NaHCO3溶液洗涤后分液;②有机层用水洗涤后分液;洗涤时不能用NaOH溶液代替NaHCO3溶液,其原因是_______(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷(b)由于其特殊的结构,一直受到化学家的重视,根据其转化关系(如图),下列说法正确的是
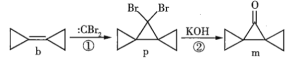
A.b的所有原子都在同一个平面内
B.b可以发生加成、氧化、加聚反应
C.p在氢氧化钠的醇溶液中加热生成烯烃
D.m的同分异构体中属于芳香化合物的共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用如图所示装置制取氯酸钾、次氯酸钠和氯水并进行有关探究实验。

实验Ⅰ:制取氯酸钾、次氯酸钠和氯水
(1)写出装置A实验室制取Cl2的化学方程式______。
(2)制取实验结束后,取出装置B中试管,冷却结晶、过滤、洗涤。该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、________、________。为提高氯酸钾和次氯酸钠的产率,在实验装置中还需要改进的是__________。
(3)装置C中反应需要在冰水浴中进行,其原因是_______。
实验Ⅱ:尾气处理。实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(4)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)。
①提出合理假设
假设1:只存在SO32-;
假设2:既不存在SO32-,也不存在ClO-;
假设3:________。
②设计实验方案,进行实验。请完成下列表格,写出相应的实验步骤以及预期现象和结论。限选实验试剂:3 mol· L-1 H2SO4、1 mol· L-1NaOH溶液、0.01 mol· L-1酸性KMnO4溶液、淀粉KI溶液。
实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液分置于A、B试管中 | |
步骤2:向A试管中滴加0.01 mol·L-1酸性KMnO4溶液 | (1)若溶液褪色,则假设1成 |
(2)若溶液不褪色,则假设2或3成立 | |
步骤3:__________ | _________ |
_________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,向100 mL含14.6 g氯化氢的盐酸溶液里放入5.60 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)氢气。在此之后,又经过4 min,铁粉完全溶解。则:
(1)在前2 min内用FeCl2表示的平均反应速率是_____________________________。
(2)在后4 min内用HCl表示的平均反应速率是______________________________。
(3)前2 min与后4 min相比,反应速率较快的是_________,其原因是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com