
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
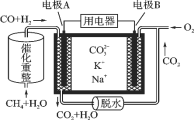
A.反应CH4+H2O![]() 3H2+CO,每消耗1mol CH4转移12 mol电子
3H2+CO,每消耗1mol CH4转移12 mol电子
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
【答案】D
【解析】
甲烷和水经催化重整生成CO和H2,反应中C元素化合价由-4价升高到+2价,H元素化合价由+1价降低到0价,原电池工作时,CO和H2为负极反应,被氧化生成二氧化碳和水,正极为氧气得电子生成CO32-。
A. 反应CH4+H2O![]() 3H2+CO,C元素化合价由-4价升高到+2价,H元素化合价由+1价降低到0价,每消耗1molCH4转移6mol电子,故A错误;
3H2+CO,C元素化合价由-4价升高到+2价,H元素化合价由+1价降低到0价,每消耗1molCH4转移6mol电子,故A错误;
B. 电极A上H2参与的电极反应为:H2+CO32--2e-=H2O+CO2,故B错误;
C. 电池工作时,CO32-向负极移动,即向电极A移动,故C错误;
D.燃料电池通入的氧气在正极上发生还原反应,B为正极,电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-,故D正确;
故选D。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】常温下,将Na2A和NaHA溶液分别进行稀释,若-lg c(Na+)=pNa、-lgc(OH-)=pOH,则测得两种溶液中pNa与pOH的关系曲线如图。下列说法正确的是( )
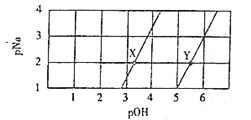
A. X点所在的直线表示NaHA溶液的稀释
B. 在Y点加入适量NaOH固体可以达到X点
C. 将X和Y点溶液等体积混合,则有c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D. 常温下,H2A的Ka1数量级为10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 688 | 810 | 860 |
①反应速率最大的时间段是____________(填0~1、1~2、2~3、3~4、4~5)min,原因是____________。
②在2~3min时间段以盐酸的浓度变化来表示的反应速率为____________。(设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列____________以减慢反应速率。(填写代号)
A.冰块B.HNO3溶液C.CuSO4溶液
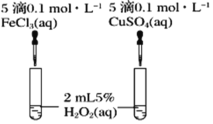
(3)C同学为了探究Fe3+和Cu2+对H2O2分解的催化效果,设计了如图所示的实验。可通过观察___________________________现象,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,分别对反应C(s)+CO2(g)![]() 2CO(g)(ΔH>0)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是
2CO(g)(ΔH>0)进行如下操作(只改变该条件):①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应速率显著变大的是
A.①②③④B.①③④C.①②D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
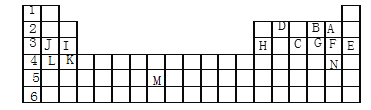
(1)表中用字母标出的14种元素中,化学性质最不活泼的是____________(用元素符号表示,下同),金属性最强的是___________,非金属性最强的是___________,常温下单质为液态的非金属元素是_________,属于过渡元素的是______________(该空用字母表示)。
(2)B,F,C气态氢化物的化学式分别为______________,其中以___________最不稳定。
(3)第三周期中原子半径最小的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如图:
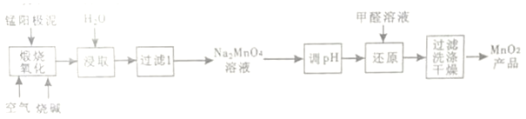
(1)“煅烧氧化”时,1molMnO煅烧完全转化为Na2MnO4失去电子___mol;
(2)为提高Na2MnO4的浸取速率,可采取的措施有___(列举2点)
(3)“调pH”是将溶液pH调至约为10,写出用pH试纸测定溶液pH的操作_____。
(4)MnO2煅烧反应的化学方程式为_____。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1.准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2.然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是___;产品中MnO2的质量分数为ω(MnO2)=___(列出计算的表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 加入合适的催化剂能降低反应活化能,从而改变反应的焓变
B. 在恒容密闭容器中发生N2(g)+3H2(g)![]() 2NH3(g)△H<0,达到平衡后升高温度可提高N2转化率
2NH3(g)△H<0,达到平衡后升高温度可提高N2转化率
C. 某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)![]() Z(g)+W(s)△H>0,当容器中气体压强不变时,该反应达到平衡状态
Z(g)+W(s)△H>0,当容器中气体压强不变时,该反应达到平衡状态
D. 对于可逆反应A(g)![]() B(g)+C(g),增大压强,正反应速率和逆反应速率都增大,并且正反应速率增大的程度大于逆反应速率增大的程度
B(g)+C(g),增大压强,正反应速率和逆反应速率都增大,并且正反应速率增大的程度大于逆反应速率增大的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A. 升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B. 0.l0mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 室温下,欲使0.1mol/L醋酸溶液的pH,电离度a都减小,可加入少量水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com