
| A. | 煤油 | B. | 液氨 | C. | 氯仿 | D. | 乙醇 |
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | ②⑥ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mo1 N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数2NA | |
| B. | 1 mol•L-1 FeCl3溶液中所含Cl-的数目为3NA | |
| C. | 标准状况下,22.4L14CO2与44g14CO2所含分子数均为NA | |
| D. | 标准状况下,16 g O3和O2混合气体中含有的氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖和果糖互为同分异构体,淀粉和纤维素也互为同分异构体 | |
| B. | 淀粉、油脂和蛋白质都能发生水解反应,淀粉水解的最终产物可与新制的Cu(OH)2反应 | |
| C. | 多糖、蛋白质、脂肪和聚丙烯都属于高分子化合物 | |
| D. | 汽油、柴油、植物油、棉、麻、丝、毛完全燃烧只生成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习查看答案和解析>>
科目:高中化学 来源: 题型:解答题
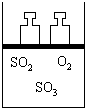 如图所示,将4mol SO2和2mol O2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,试回答:
如图所示,将4mol SO2和2mol O2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
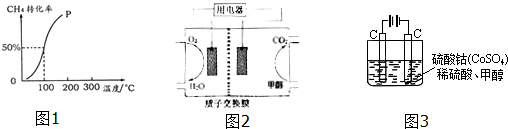
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
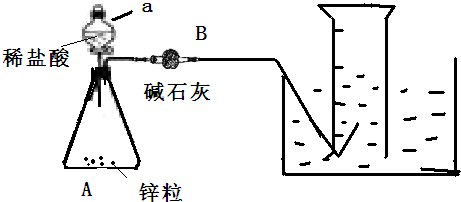
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com